Files.socextremehta.webnode.es
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Las medidas higiénico-dietéticas para el control de la diabetes mellitus incluyen las pautas de alimentación y la activi- dad física, siendo ambas tan importantes como el tratamiento farmacológico en el control glucémico y metabólico en general y pueden ser el tratamiento exclusivo en algunos casos de diabetes mellitus tipo 2 durante los primeros años de evolución desde el diagnóstico. La intervención nutricional en los pacientes con diabetes se debe dirigir no sólo al con- trol glucémico, sino también al control de los parámetros lipídicos y de tensión arterial1. Cuando se realiza un tratamiento nutricional especializado a los pacientes con diabetes mellitus, se ha demostrado una reducción de ingresos hospitala- rios del 9'5% y un 23'5% de disminución de consultas médicas2. El tratamiento de los pacientes con diabetes mellitus incluye la ingesta, la actividad física y, en muchas ocasiones, el tra- tamiento farmacológico, oral o subcutáneo. Un plan de comidas basado en la ingesta habitual del paciente debe ser la base para integrar el tratamiento con insulina y/o algunos antidiabéticos orales con los patrones de ingesta y actividad física y no adaptar la ingesta al tratamiento porque esto dificulta el cumplimiento por parte del paciente. Los pacientes en tratamiento con insulina humana deben tomar las ingestas de forma ajustada al tiempo de acción de las insulinas prescritas, siendo esto innecesario en el caso de tratamiento con análogos de insulina; el cálculo de las dosis de insulina de acción rápida debe realizarse en función de la ingesta de hidratos de carbono que vaya a realizar, así como la glucemia que presente en ese momento. El tratamiento con insulina en pauta basal-bolos o con bomba de insulina permite mayor flexibilidad en el horario de las ingestas así como en la cantidad de hidratos de carbono que se pueden tomar; de todas maneras, es conveniente que eviten saltarse comidas. Para pautar el tratamiento dietético, es conveniente determinar las necesidades calóricas para el peso, sexo, edad y actividad física y volver a realizarlas periódicamente, en función del cambio de peso y de actividad física.En la mayoría de pacientes con diabetes mellitus de tipo 2, dado que presentan sobrepeso u obesidad, es preciso con- trolar el peso corporal y realizar una restricción calórica entre 250 y 500 kcal/día inferior a la ingesta habitual, con el objetivo inicial de perder entre el 5% y el 10% del peso corporal, que ha demostrado que, además de ayudar a controlar la glucemia, mejora los niveles lipídicos y la tensión arterial. Los pacientes con mucha resistencia a la insulina se pueden beneficiar de perder más peso con una dieta de bajo índice glucémico3. Por último, repartir la ingesta total del día en más tomas y no omitir el desayuno ayuda a mejorar los niveles lipídicos y la sensibilidad postprandial a la insulina en los pacientes con diabetes mellitus de tipo 24. En la tabla 1 se muestran las recomendaciones nutricionales generales de la American Diabetes Association5.
Tabla 1 - Recomendaciones nutricionales generales de la ADA. (5)
Las personas con diabetes mellitus o prediabetes deben recibir tratamiento nutricional adaptado para lograr los objetivos del tratamiento (Grado de recomendación A).
El tratamiento nutricional es coste-efectivo y mejora los resultados de salud (B).
En personas obesas o con sobrepeso insulinorresistentes, una pérdida de peso moderada reduce la resistencia a la insulina, por o que se recomienda que estos pacientes pierdan peso (A).
Para perder peso, pueden ser efectivas a corto plazo (< 1 año) las dietas hipocalóricas tanto bajas en carbohidratos como las bajas en grasa (A).
- Hidratos de carbono.
Los hidratos de carbono digeribles proporcionan energía como principal misión, 4 kcal por gramo (16'7 kJ/g), descen- diendo a 3'75 kcal/g (15'7 kJ/g) si se trata de monosacáridos6; de hecho, más de la mitad de la energía aportada por la dieta debe provenir de carbohidratos y no es saludable tomar una alimentación pobre en ellos; además, no se ha demostrado que las dietas pobres en carbohidratos sean más útiles a largo plazo para perder peso7, que es un objetivo importante en muchos pacientes con diabetes mellitus de tipo 2. La cetosis se puede prevenir si se toman al menos el 45% de las necesidades calóricas en forma de hidratos de carbono, por lo que las necesidades de éstos se encuentran entre el 45% y el 65%8.
Las principales fuentes dietéticas de hidratos de carbono en la dieta deben ser, cuantitativamente, los cereales (>70% de hidratos de carbono en su peso en crudo), legumbres (50-60%), verduras, hortalizas y frutas, que la presentan en menor proporción, debido fundamentalmente a su mayor contenido acuoso9. Otras funciones importantes de los hidratos de carbono son la regulación de la saciedad precoz10, del metabolismo de la insulina y la glucemia11 (ver el concepto de índice glucémico), la glicosilación proteica, la dehidroxilación de ácidos bilia- Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos res y la participación en el metabolismo de los triglicéridos (los azúcares incrementan los triglicéridos plasmáticos en un 60%)12. En cuanto a otras funciones de otros hidratos de carbono, es destacable el funcionamiento como fibra dietética de los oligosacáridos y polisacáridos no digeribles.
Se recomienda incrementar la ingesta de fibra e hidratos de carbono complejos con cereales integrales, frutas sin pelar y verduras, para lo que es útil una dieta vegetariana no estricta baja en grasas, que además ayuda a controlar el peso y a mejorar la sensibilidad a la insulina y el control glucémico13.
En las tablas 2 y 3 se exponen las recomendaciones de la ADA y la EASD, respectivamente, sobre el consumo de hidratos de carbono por parte de los pacientes diabéticos5,14.
Tabla 2 - Recomendaciones de la ADA y grado de evidencia (5)
Las dietas bajas en carbohidratos (<130 g/día) no se recomiendan para el tratamiento del sobrepeso o la obesidad ni en el control de la diabetes. (Grado de recomendación B).
No hay suficiente información consistente para concluir que las dietas de baja carga glucémica reduzcan el riesgo de diabetes. Sin embargo, se debe fomentar el consumo de alimentos de bajo índice glucémico ricos en fibra y otros nutrientes importantes (E).
Se recomienda un patrón dietético que incluya carbohidratos procedentes de frutas, verduras, cereales integrales y leche desnatada para un buen estado de salud (B).
El control de los carbohidratos de la dieta, ya sea contando raciones, intercambios o mediante una estimación basada en la experiencia es clave para el control glucémico (A).
Los alimentos que contengan sacarosa pueden ser sustituidos por otros carbohidratos o cubiertos con suficiente insulina u otros hipoglucemiantes y se debe evitar el exceso de calorías aportadas (A).
Considerar la ingesta de carbohidratos, tanto por raciones como por intercambios como por estimación experimentada es una estrategia clave en lograr el control glucémico (A). En los pacientes con dietas bajas en carbohidratos se deben monitorizar la lipemia, la función renal y la ingesta proteica (en los nefrópatas) y ajustar el tratamiento hipoglucemiante (E). Tabla 3 - Recomendaciones de la EASD (European Association for the Study of Diabetes) y grado de recomendación
(Agency for the Health Care Policy and Research and the Scottish Intercollegiate Guidelines Network). (14)
La ingesta de carbohidratos puede situarse entre un 45-60 % de la energía total consumida (C).
Las características metabólicas sugieren las ingestas más adecuadas dentro de este rango para diabéticos tipo 1 y 2 (A).
Las verduras, las legumbres, los cereales de grano entero y las frutas deben incorporarse a la dieta de las personas con diabetes. Cuando la ingesta de carbohidratos se sitúa en el rango alto de las recomendaciones, es particularmente importante insistir en los alimentos con alto contenido en fibra y bajo índice glucémico (A).
No hay justificación para recomendar dietas con muy bajo contenido en carbohidratos en personas con diabetes (B).
La cantidad de carbohidratos, la fuente y su distribución a lo largo del día debería ser tenida en cuenta para facilitar un control glucémico óptimo a largo plazo. En los tratados con insulina o agentes hipoglucemiantes, el tiempo y la dosis de la medicación deberían ajustarse a la cantidad y a la naturaleza de los carbohidratos (C).
Si se desea, y el control glucémico es bueno, pueden incorporarse a la dieta pequeñas cantidades de azúcares (hasta 50 g al día) (A).
Como para población general, la ingesta de azúcares simples no debe sobrepasar el 10 % de las Kcal diarias. Un consejo más restricitivo puede aplicarse a aquéllos que deben perder peso (C).
- Índice y carga glucémicos.
Para mejorar el control glucémico de los pacientes con diabetes mellitus, se debe emplear un método de cálculo de racio-
nes de hidratos de carbono (1 ración equivale a 10 g de hidratos de carbono), más que considerar la fuente de los mismos o calcular la energía total de las ingestas15. Si se tiene en cuenta el índice o, mejor, la carga glucémica de los alimentos, se puede lograr un beneficio adicional en el control glucémico5. Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos El índice glucémico (8) resulta de determinar el área bajo la curva de la glucemia a lo largo del tiempo tras la ingesta de un determinado alimento y de relacionar esta área con el que resulta de la ingesta de un alimento estándar, generalmente el pan blanco o glucosa, al que se le da un valor de 100 (Figura 1). Figura 1 - Glucemia a lo largo del tiempo tras la ingesta de 50 g de glucosa, pan blanco o pan integral. El área bajo la curva
del pan blanco o integral respecto al área bajo la curva de la glucosa nos da los índices glucémicos.
Este índice nos da una idea del incremento de glucemia que se puede atribuir a cada alimento; sin embargo, no hay que olvidar que cada comida se compone de varios alimentos que interrelacionan entre sí y se puede modificar la respuesta glucémica en función de, por ejemplo, la velocidad de vaciamiento gástrico. (Tabla 4) Tabla 4 - Factores alimentarios que modifican la respuesta glucémica.
Cantidad de carbohidratos Tipo de monosacáridos Glucosa, fructosa, galactosa Naturaleza del almidón Amilosa, amilopectina, almidón resistente, interacción con otros nutrientes Elaboración de los alimentos Gelatinización del almidón, tamaño y forma de partículas, estructura celular Otros componentes de la dieta Grasa, proteínas, fibra, ácidos orgánicos, antinutrientes Modificado de FAO/OMS, 1999 (8).
Los alimentos con elevado índice glucémico favorecen la ganancia de peso por la hiperinsulinemia postprandial16 y la hiperglucemia producida puede causar diabetes mellitus de tipo 2 por la glucotoxicidad sobre las células beta del pán- creas17. Por el contrario, los alimentos con bajo índice glucémico disminuyen la insulinorresistencia y la hiperinsulinemia postprandial18. Por ello, una dieta rica en cereales integrales disminuye el riesgo de diabetes mellitus, mejora el control de quienes ya son diabéticos, que tienen menos oscilaciones glucémicas, y disminuye el riesgo cardiovascular19,20. La ingesta de comidas variadas que contengan carbohidratos de absorción lenta, con bajos índice glucémico e insuline- mia postprandial reducen la acumulación de lipoproteínas ricas en triglicéridos en los obesos21.
La carga glucémica es útil en predecir el impacto total de la comida sobre la glucemia e insulinemia postprandiales, considerando tanto la cantidad de hidratos de carbono como el índice glucémico del alimento (carga glucémica = índice glucémico respecto a glucosa x gramos de carbohidratos en 100 g de alimento). Dos comidas con similar carga glucé- mica, aunque tengan distinta cantidad de hidratos de carbono y de distinto índice glucémico, da lugar a glucemias e insulinemias comparables22. En la Tabla 5 se presentan los índices y cargas glucémicas de algunos alimentos; apréciese la gran diferencia en algunos alimentos entre el índice glucémico y su carga glucémica.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Tabla 5 - Índice y carga glucémicas de algunos alimentos. IG: índice glucémico respecto a glucosa. CG: carga glucémica.
Modificado de Cordain et al., 200523.
Cereales de arroz Cereales de maíz Cereales integrales Habitualmente no se consideran para la carga glucémica los alimentos con escaso contenido en hidratos de carbono (menos de media ración) y para ello se ha desarrollado la carga glucémica equivalente, que es un método válido, preciso y sensible para valorar el impacto sobre la glucemia de los alimentos con bajo contenido en hidratos de carbono, si bien es más compleja de calcular24.
A pesar de lo anteriormente expuesto y aunque existen datos bromatológicos completos, tanto el índice glucémico como la carga glucémica tienen una utilidad clínica limitada dada su alta variabilidad y baja reproducibilidad25.
- Lípidos.
Entre hidratos de carbono y ácidos grasos monoinsaturados se debe tomar entre el 60% y el 70% de las necesidades calóricas diarias; una dieta rica en ácidos grasos monoinsaturados puede tener un efecto favorable en el perfil lipídico26. El total de ácidos grasos debe ser entre el 25% y el 35%, los ácidos grasos saturados se deben limitar a menos del 10%27, los ácidos grasos trans deben evitarse y se deben incluir alimentos que aporten ácidos grasos poliinsaturados omega-3 (pescados azules) para ayudar al control lipídico y disminuir el estado inflamatorio5. Respecto a otros tipos de grasa, se recomienda una ingesta de ácidos grasos poliinsaturados del 10% de la ingesta calórica total, de monoinsaturados entre el 10% y el 15% y de colesterol inferior a 300 mg/día.
En la tabla 6 se recogen las recomendaciones de la ADA sobre el consumo de lípidos por las personas con diabetes me- Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Tabla 6 - Recomendaciones de la ADA sobre la ingesta de lípidos y grado de recomendación. (5)
La ingesta de grasas saturadas debería ser inferior al 7% de la ingesta calórica total (A).
Reducir la ingesta de ácidos grasos trans disminuye el colesterol LDL y aumenta el HDL (A).
Se debe reducir en lo posible la ingesta de ácidos grasos trans (E).
- Proteínas.
La ingesta proteica debe suponer entre el 15% y el 20% de las necesidades energéticas, si bien hay que ser rigurosos en
mantener un aporte de 0'8 g de proteínas por kg de peso y día si existe enfermedad renal y este aporte puede controlarse más aún en fases avanzadas de nefropatía. Una dieta ligeramente hiperproteica puede ayudar a incrementar la sensibi- lidad a la insulina cuando se precisa perder peso28, aunque no se deben disminuir los hidratos de carbono del 45% del aporte calórico total, según las recomendaciones de la ADA. Además de lo anterior, se recomienda una baja ingesta de colesterol y dietas de bajo índice glucémico29. Para aumentar los ácidos grasos poliinsaturados y disminuir los saturados, es útil el tipo de dieta mediterránea30; y tomar comidas menos copiosas y seleccionar alimentos con menor índice glucé- mico puede ser de utilidad30.
- Fibra dietética.
Las dietas muy ricas en fibra (50 g/día), reducen la glucemia en los pacientes con diabetes mellitus tipo 1 y 2 y la hiperin- sulinemia y lipemia en la tipo 231; además, un metaanálisis ha encontrado que el incremento de la ingesta de fibra en las poblaciones occidentales, donde esta ingesta es baja, contribuye a prevenir la hipertensión arterial32. Según las recomendaciones de la ADA, las personas con elevado riesgo de padecer diabetes mellitus tipo 2 deben seguir las recomendaciones del Departamento de Agricultura de los Estados Unidos de ingerir al menos 14 gramos de fibra por cada 1000 kcal de la dieta e ingerir alimentos con cereales integrales, al menos la mitad de la ingesta total de derivados de cereales. (Grado de recomendación B)5 En la tabla 7 se exponen las recomendaciones de la EASD sobre el consumo de fibra por los pacientes con diabetes mellitus14. Tabla 7 - Recomendaciones de la EASD sobre el consumo de fibra y grado de recomendación. (14)
Las personas con diabetes mellitus tipo 1 y 2 deben ser instruidas en el consumo de alimentos naturales ricos en fibra (A).
Idealmente la ingesta de fibra debe ser de más de 40 g diarios (o 20 g / 1000 kcal); la mitad soluble. También se obtienen efectos beneficiosos con cantidades más bajas –para algunos más aceptables- (A).
El consumo diario de al menos 5 raciones de verduras o fruta , y de 4 raciones de legumbres por semana pueden ayudar a alcanzar los requerimientos mínimos de ingesta de fibra (C).
Los alimentos derivados de los cereales deberían ser de grano entero y ricos en fibra (B).
Es aconsejable el empleo de edulcorantes acalóricos para proporcionar sabor dulce a los alimentos y el consumo de éstos, incluidos los azúcares-alcohol, es seguro si se consumen en los niveles establecidos por las autoridades sanitarias (FDA). (Grado de recomendación A)5 El sabor dulce proporcionado por aspartamo, acesulfame potásico y sacarina incrementa el apetito y, en el último caso, la ingesta; sin embargo, el consumo de aspartamo se ha asociado con ingestas estables o menores a pesar de incrementar el apetito. En ningún caso se han asociado con ganancia ponderal33. Hay una fuerte evidencia sobre la capacidad de prevenir las caries mediante el consumo regular de chicles edulcorados con xilitol34.
Por sus efectos y al sustituir a la sacarosa y la fructosa, sobre todo los edulcorantes acalóricos, se emplean para ayudar a perder peso, el control de la diabetes mellitus, evitar hipoglucemias reactivas y el cuidado dental.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos - Otros nutrientes y alimentos.
El aporte de vitaminas y minerales debe realizarse según la ADA y no se aconseja su suplementación rutinaria15.
El alcohol, cuando se ingiera, debe hacerse acompañado de hidratos de carbono para prevenir la hipoglucemia y limitado a una unidad al día en mujeres y dos en los varones15). El alcohol, en cantidades moderadas, no aumenta los triglicéridos, disminuye la incidencia de diabetes y de cardiopatía en diabéticos35, probablemente porque el alcohol mejora la sensibi- lidad a la insulina y aumenta el colesterol HDL.
Media cucharadita de canela diaria disminuye la glucemia, el colesterol y los triglicéridos y mejora la sensibilidad a la insulina en los diabéticos de tipo 236,37).
En la tabla 8, se exponen algunas recomendaciones de la ADA sobre estos nutrientes y alimentos.
Tabla 8 - Recomendaciones sobre otros nutrientes y alimentos. (5)
Si los adultos con diabetes toman alcohol, limitar su ingesta a una cantidad moderada (E).
No se aconseja suplementar de forma rutinaria con antioxidantes como las vitaminas C y E y los carotenos por la falta de evidencia y la preocupación sobre su seguridad a largo plazo (A).
No se ha demostrado beneficio del suplemento con cromo en los diabéticos y no puede recomendarse (C).
Los planes dietéticos individualizados deberían incluir una optimización de la elección de alimentos para llegar a las recomendaciones de todos los micronutrientes (E). Debe recomendarse una actividad física diaria, moderada, no inferior a 30 minutos, debiendo ser al menos la mitad del mismo aeróbico29. Una actividad física de al menos 150 minutos semanales de actividad aeróbica moderada (50%-70% de la frecuencia cardiaca máxima) o 90 minutos semanales de actividad aeróbica intensa (>70% de frecuencia cardiaca máxima), repartidos al menos en 3 días a la semana, mejora el control glucémico, ayuda a mantener un peso adecuado y reduce el riesgo de enfermedades cardiovasculares5; otra recomendación sencilla es realizar actividad física media hora diaria38,39. El ejercicio físico debe comenzarse de forma poco intensa e irse incrementando gradualmente40, aunque un ejercicio intenso puede ser perjudicial para pacientes con neuropatía, retinopatía y enfermedad coronaria. En la tabla 9 se muestran las recomendaciones de la ADA relativas a la actividad física.5 Tabla 9 - Recomendaciones de la ADA referidas a la actividad física. (5)
La actividad física y las modificaciones conductuales son componentes importantes de los programas de pérdida de peso y son los que más ayudan a mantener la pérdida de peso (B).
Se debería aconsejar a los diabéticos que realicen al menos 150 minutos semanales de actividad física aeróbica de moderada intensidad (50-70% de fecuencia cardiaca máxima) a la semana (A).
Si no hay contraindicaciones, se debe animar a los diabéticos de tipo 2 a realizar entrenamiento de resistencia tres veces por Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 1. Kulkarni K. Diets do not fail: the success of medical nutrition therapy in patients with diabetes. Endocr Pract 2006; 12 (Suppl 1): 121S-123S.
2. Johnson RK. The Lewin Group Study: what does it tell us, and why does it matter? J Am Diet Assoc 1999; 99: 428- 3. Pittas AG, Das SK, Hajduk CL, et al. A low-glycemic load diet facilitates greater weight loss in overweight adults with high insulin secretion but not in overweight adults with low insulin secretion in the CALERIE trial. Diabetes Care 2005; 28 (12): 2939-2941.
4. Farshchi HR, Taylor MA, Macdonald IA. Beneficial metabolic effects of regular meal frequency on dietary thermo- genesis, insulin sensitivity, and fasting lipid profiles in healthy obese women. Am J Clin Nutr 2005; 81 (2): 388- 5. American Diabetes Association. Standards of medical care in diabetes mellitus – 2010. Diabetes Care 2010; 33: 6. Arilla E. Estructura y metabolismo de carbohidratos. En: Hernández M y Sastre A (eds.) Tratado de Nutrición. Ma- drid: Díaz de Santos, 1999; 53-100.
7. Strychar I. Diet in the management of weight loss. CMAJ 2006; 174 (1): 56-63.
8. Varios (Consulta FAO/OMS de expertos sobre los carbohidratos en la nutrición humana) En: Los carbohidratos en la nutrición humana: informe de una consulta mixta FAO/OMS de expertos, Roma, 14-18 de abril de 1997. Roma: FAO, 1999.
9. Jiménez A, Cervera P y Bacardí M. Tabla de composición de Alimentos Novartis Nutrition Barcelona: Novartis Consumer Health, 1997.
10. Anderson GH, Woodend D. Consumption of sugars and the regulation of short-term satietyand food intake. Am J Clin Nutr 2003; 78 (4): 843S-849S.
11. Herman MA, Kahn BB. Glucose transport and sensing in the maintenance of glucose homeostasis and metabolic harmony. J Clin Invest 2006; 116 (7): 1767-1775.
12. Fried SK, Rao SP. Sugars, hypertriglyceridemia, and cardiovascular disease. Am J Clin Nutr 2003; 78 (4): 873S- 13. Barnard ND, Scialli AR, Turner-McGrievy G, Lanou AJ, Glass J. The effects of a low-fat, plant-based dietary inter- vention on body weight, metabolism, and insulin sensitivity. Am J Med 2005; 118 (9): 991-997.
14. J.I. Mann, I. De Leeuw, K. Hermansen, B. Karamanos, B. Karlström, N. Katsilambros, G. et al. and Diabetes and Nutrition Study Group (DNSG) of the European Association for the Study of Diabetes (EASD). Evidence-based nutritional approaches to the treatment and prevention of diabetes mellitus. Nutr Metab Cardiovasc Dis. 2004; 15. Franz M, Bantle JP, Beebe CA, et al. Evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related conditions. Diabetes Care 2002; 25 (1): 148-198.
16. Slyper AH. The pediatric obesity epidemic: causes and controversies. J Clin Endocrinol Metab 2004; 89 (6): 2540- 17. Robertson RP, Harmon J, Tran PO, Tanaka Y, Takahashi H. Glucose toxicity in beta-cells: type 2 diabetes, good radicals gone bad, and the glutathione connection. Diabetes 2003; 52 (3): 581-587.
18. Daly M. Sugars, insulin sensitivity, and the postprandial state. Am J Clin Nutr 2003; 78 (4): 865S-872S.
19. Willet W, Manson J, Liu S. Glycemic index, glycemic load, and the risk of type 2 diabetes. Am J Clin Nutr 2002; 76 (1): 274S-280S.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 20. Björck I, Elmstahl HL. The glycaemic index: importante of dietary fibre and other food properties. Proc Nutr Soc 2003; 62: 201-206.
21. Horbis A, Perdreau S, Vincent-Baudry S, Charbonnier M, Bernard MC, Raccah D, et al. Glycemic and insulinemic meal responses modulate postprandial hepatic and intestinal lipoprotein accumulation in obese, insulin-resis- tant subjects. Am J Clin Nutr 2004; 80: 896-902.
22. Galgani J, Aguirre C, Díaz E. Acute effect of meal glycemic index and glycemic load on blood glucosa and insulin responses in humans. Nutr J 2006; 5: 22-28.
23. Cordain L, Eaton SB, Sebastian A, Mann N, Lindeberg S, Watkins BA, et al. Origins and evolution of the Western diet: health implications for the 21st century. Am J Clin Nutr 2005; 81: 341-354.
24. Wolever TMS, Gibas AL, Spolar M, Hitchner EV, Heimowitz C. Equivalent glycemic load (EGL): a method for quan- tifying the glycemic responses elicited by low carbohidrate foods. Nutrition & Methabolism 2006; 3: 33-43.
25. Arteaga Llona A. El índice glucémico. Una controversia actual. Nutr Hosp. 2006; 21 (Supl. 2): 55-60.
26. Strychar I, Isaac A, Rivard M, et al. Impact of a high-monounsaturated-fat diet on lipid profile in subjects with type 1 diabetes. J Am Diet Assoc 2003; 103 (4): 467-474.
27. Kelley DE. Sugars and starch in the nutritional management of diabetes mellitus. Am J Clin Nutr 2003; 78 (4): 28. Sargrad KR, Homko C, Mozzoli M, Boden G. Effect of high protein vs high carbohydrate intake on insulin sensiti- vity, body weight, hemglobin A1c, and blood pressure, in patients with type 2 diabetes. J Am Diet Assoc 2005; 105 (4): 573-580.
29. Bestermann W, Houston MC, Basile J, et al. Addressing the global cardiovascular risk of hipertensión, dyslipide- mia, diabetes mellitus, and the metabolic syndrome in the southeatern United Status, part II: treatment recom- mendations for management of the global cardiovascular risk of hipertensión, dyslipidemia, diabetes mellitus, and the metabolic syndrome. Am J Med Sci 2005; 329 (6): 292-305.
30. Maki K, Kurlandsky S. Syndrome X: A tangled web of risk factors for coronary heart disease and diabetes melli- tus. Top Clin Nutr 2001; 16 (2): 32-41.
31. Franz MJ, Bantle JP, Beebe CA, Brunzell JD, Chiasson JL, Garg A, et al. Evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related complications. Diabetes Care 2002; 25: 148-198.
32. Streppel MT, Arends LR, van't Veer P, Grobbre DE, Geleijnse JM. Dietary fiber and blood pressure. A meta-analysis of ramdomized placebo-controlled trials. Arch Intern Med 2005; 165: 150-156.
33. Rolls BJ. Effects of intense sweeteners on hunger, food intake and body weight: a review. Am J Clin Nutr 1991; 53: 872-878.
34. Burt BA. The use of sorbitol- and xylitol sweetened chewing gum in caries control. JADA 2006; 137: 190-196.
35. Howard AA, Arnsten JH, Gourevich MN. Effect of alcohol consumption on diabetes mellitus. A systematic review. Ann Intern Med 2004; 140 (3): 211-219.
36. Kahn A, Safdar M, Ali Khan MM, Khattak KN, Anderson RA. Cinnamon improves glucosa and lipids of people with type 2 diabetes. Diabetes Care 2003; 26 (12): 3215-3218. 37. Anderson RA, Broadhurst CL, Polansky MM, et al. Isoation and characterization of polyohenol type-A polymers from cynammon with insulin-like biological activity. J Agric Food Chem 2004; 52 (1): 65-70.
38. Church TS, Cheng YJ, Earnest CP, et al. Exercise capacity and body composition as predictors of mortalityamong men with diabetes. Diabetes Care 2004; 27 (1): 83-88. 39. Kriska AM, Saremi A, Hanson RL, et al. Physical activity, obesity, and the incidence of type 2 diabetes in a high risk population. Am J Epidemiol 2003; 158 (7): 669-675.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 40. Dunstan DW, Daly RM, Owen N, et al. High-intensity resistance training improves glycemic control in older pa- tients with type 2 diabetes. Diabetes Care 2002; 25 (10): 1729-1736.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos CONTROL DE LA GLUCEMIA
La diabetes tipo 2 es una enfermedad metabólica crónica, cuya prevalencia sigue aumentando en todo el mundo. Esta enfermedad se caracteriza por la presencia de hiperglucemia de ayuno e hiperglucemia posprandial, consecuencia de diversas alteraciones metabólicas 1. Entre los factores implicados, la secreción inapropiada de insulina y la resistencia a la insulina siguen siendo los defectos fisiopatológicos más importantes. La hiperglucemia crónica induce glicación proteica excesiva. Además, los pacientes con diabetes pueden verse afectados también por las fluctuaciones glucémicas agudas, que ocurren a diario, y que se engloban dentro del término de variabilidad glucémica 2. Las fluctuaciones agudas de la glucosa pueden activar el estrés oxidativo y producir disfunción endotelial, alteraciones que podrían tener también un papel en el desarrollo de las complicaciones crónicas de la diabetes 3. Los estudios de intervención en pacientes con diabetes tipo 1 y tipo 2 demostraron, de forma concluyente, que reducien- do la hemoglobina glicosilada (HbA ) a ≤7% se podía prevenir la aparición y/o la progresión de las complicaciones cróni- cas microvasculares 4,5,6,7,8. Sin embargo, en estos estudios, el efecto del control glucémico intensivo sobre la enfermedad cardiovascular resultaba controvertido. Aunque el análisis epidemiológico de los datos del United Kingdom Prospective Diabetes Study (UKPDS) sugería un efecto beneficioso del control intensivo de la glucemia sobre la enfermedad cardio- vascular, la mortalidad cardiovascular y la mortalidad por todas las causas 9. En la última década se diseñaron diversos estudios de intervención en pacientes con diabetes tipo 2 con la intención de demostrar el beneficio del control intensivo de la glucemia en la reducción de la morbimortalidad cardiovascular. Los resultados de estos estudios, publicados hace 2 años, han resultado también controvertidos. Mientras que el estudio ADVANCE (The Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation) y el VADT (Veterans Affaires Diabetes Trial) no demostraron efectos negativos del control intensivo sobre la aparición de eventos cardiovasculares 10,11, el estudio ACCORD (The Action to Control Cardiovascular Risk in Diabetes Study Group) encontró un aumento de riesgo de muerte por causas cardiovasculares y de mortalidad global en el grupo de pacientes tratado de forma intensiva 12. En consecuencia, en el momento actual existe debate sobre la conveniencia de instaurar un tra- tamiento intensivo en la diabetes tipo 2, y sobre el nivel deseable de HbA a alcanzar en estos pacientes. En este ma- nuscrito se revisarán las últimas evidencias disponibles sobre el tema y las recomendaciones actuales sobre el control glucémico en los pacientes con diabetes tipo 2.
ESTUDIOS RECIENTES SOBRE LOS BENEFICIOS DEL CONTROL GLUCÉMICO INTENSIVO
A continuación se exponen los estudios de intervención más recientemente publicados sobre el tratamiento de la hiper- glucemia en la diabetes tipo 2.
Estudios de intervención en pacientes con diabetes tipo 2 con enfermedad cardiovascular o con elevado riesgo cardiovascularLos estudios que se exponen a continuación fueron diseñados para evaluar el beneficio del control intensivo de la glu- cemia en pacientes con diabetes tipo 2 avanzada, con enfermedad cardiovascular presente al inicio del estudio, o con diversos factores de riesgo cardiovascular.
Estudio ACCORD 12.
En este estudio se incluyeron 10.251 pacientes adultos con diabetes tipo 2, con una edad media de 62 años y una dura- ción de la diabetes de 10 años. Los pacientes fueron aleatorizados a un tratamiento intensivo con el objetivo de conseguir una HbA <6%, utilizando cualquier combinación terapéutica, o a un tratamiento convencional con objetivos menos am- biciosos (HbA entre 7-7,9%). Al inicio del estudio todos los pacientes presentaban enfermedad cardiovascular o elevado riesgo de padecerla. Después del primer año, la mediana de HbA alcanzada en el grupo intensivo fue de 6,4% vs. 7,5% en el grupo convencional. Estas diferencias se mantuvieron durante 3,5 años, hasta la interrupción temprana de la rama intensiva de tratamiento por un incremento inesperado de la mortalidad por todas las causas (5,0% vs. 4,0%, hazard ratio 1,22; 95% CI 1,01-1,46, p=0,04), que era una variable secundaria en este estudio. Respecto a la variable principal, que incluía la primera aparición de infarto de miocardio no fatal, accidente vascular cerebral no fatal y muerte cardiovascular, no pudieron demostrarse beneficios significativos, aunque sí una tendencia favorable en el grupo de control glucémico intensivo (6,9% vs. 7,2%, HR 0,90; 95% CI 0,78-1,04, p=0,16). No se pudieron identificar las causas del incremento de la mortalidad, aunque se observó un incremento en la incidencia de hipoglucemias graves (10,5% vs. 3,5%, p<0,001) y una mayor frecuencia de incremento de peso excesivo (>10 Kg) en el grupo de tratamiento intensivo. Los análisis realizados posteriormente ("post-hoc") demostraron una mayor mortalidad en los pacientes con enfermedad cardiovascular ya co- nocida y en aquellos con una HbA basal > 8,5%. Por el contrario, aquellos sin enfermedad cardiovascular previa y con una HbA basal < 8,0% presentaban beneficios significativos con el tratamiento intensivo.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Estudio ADVANCE 10 En este estudio, 11.140 pacientes adultos con diabetes tipo 2 (edad media de 66 años, duración media de diabetes de 8 años), afectos de enfermedad microvascular o macrovascular, o al menos otro factor de riesgo, fueron aleatorizados a un control intensivo de la glucemia con el objetivo de alcanzar una HbA ≤6,5%, o convencional, siguiendo las guías de tratamiento local de los investigadores. El tratamiento en el grupo intensivo fue iniciado con gliclacida, a la que se fue- ron incorporando nuevos agentes orales o insulina en caso necesario. Después de 5 años, la media de HbA en el grupo intensivo fue de 6,5% frente a 7,3% en el grupo convencional. El control intensivo de la glucemia tuvo un efecto positivo en la variable principal, una combinación de eventos micro- y macrovasculares mayores (18,1% vs. 20,0%, HR 0,90; 95% CI 0,82-0,98, p=0,01), a expensas fundamentalmente de una reducción importante de las complicaciones microvascula- res, especialmente la nefropatía diabética. No se detectaron diferencias en los eventos macrovasculares mayores ni en la mortalidad. Al igual que en el estudio ACCORD, el tratamiento intensivo fue responsable de una mayor frecuencia de hipoglucemias graves (al menos un episodio, 2,7% vs. 1,5%, HR 1,86; 95% CI 1,42-2,40, p<0,001).
Estudio VADT 11 El estudio VADT, de menor magnitud, reclutó a 1.791 pacientes adultos con diabetes tipo 2, con una edad media de 60 años, 97% varones, y con una duración promedio de diabetes de 12 años. Basalmente, estos pacientes presentaban un control glucémico subóptimo, y fueron aleatorizados a un tratamiento intensivo con el objetivo de conseguir una HbA <6%, o convencional con una finalidad menos ambiciosa (HbA entre 8-9%). La mediana de HbA alcanzada en el grupo intensivo fue de 6,9% vs. 8,4% en el grupo de tratamiento convencional. Tras un seguimiento de 5,6 años no se pudieron demostrar diferencias en la variable principal preespecificada (HR 0,88; 95% CI 0,74-1,05, p=0,14), que incluía infarto de miocardio, accidente vascular cerebral, muerte cardiovascular, insuficiencia cardiaca, cirugía por enfermedad vascular periférica, enfermedad coronaria inoperable y amputación por isquemia. No se detectaron tampoco diferencias en los grupos respecto a la mortalidad por todas las causas (HR 1,07; 95% CI 0,81-1,42, p=0,62). Un análisis posterior indicó beneficios del control intensivo de la glucemia en los pacientes con una diabetes de menos de 12 años de duración, y un efecto deletéreo en aquel os con mayor duración de la enfermedad. Las hipoglucemias graves fueron hasta 3 veces más frecuentes en los pacientes del grupo intensivo. Además, pudo objetivarse que las hipoglucemias graves, ocurridas en los 90 días previos, fueron predictoras importantes de la variable principal y de la muerte por causas cardiovasculares. Finalmente, también estos pacientes incrementaron el peso en 4 Kg frente al grupo de tratamiento convencional.
Las características comparativas de estos 3 estudios de intervención a corto-medio plazo se resumen en la tabla 1.
Estudios de intervención a largo plazo en pacientes con diabetes tipo 2 de inicio reciente Estudio UKPDS-Post Trial Monitoring 13.
El estudio UKPDS 6 fue diseñado para evaluar el efecto del tratamiento intensivo de la glucemia en pacientes con diabe- tes tipo 2, de reciente diagnóstico. Este estudio de intervención finalizó en 1997, después de una media de seguimiento de 10 años, y sus resultados fueron publicados en 1998. En este grupo de pacientes, el tratamiento intensivo de la glucemia (HbA 7%) fue capaz de disminuir las complicaciones microvasculares en un 25% frente al tratamiento con- vencional (HbA 7,9%). Además, en análisis posteriores, se demostró un relación continua entre la disminución de la glucemia y la reducción del riesgo de complicaciones microvasculares, sin que pudiera identificarse un dintel aparente a este beneficio, incluso en valores normales de HbA 9. Tras la finalización del estudio de intervención, un gran número de estos pacientes (n= 3.277) fueron seguidos de forma prospectiva durante 10 años más. Aunque las diferencias en el control glucémico alcanzado entre los 2 grupos de la fase de intervención (intensivo vs. convencional) desaparecieron después del primer año (figura 1), los beneficios obser- vados del control intensivo sobre las complicaciones microvasculares se mantuvieron hasta 20 años después. Además, en este análisis a largo plazo, se pudieron demostrar una reducción en el riesgo de infarto de miocardio (15%, p=0,01) y en la mortalidad por todas las causas (13%, p=0,007), en pacientes tratados originalmente en el grupo intensivo con sulfonilureas o insulina. También se confirmaron y ampliaron los beneficios de la metformina sobre la reducción del riesgo de infarto de miocardio (33%) y de la mortalidad por todas las causas (27%). En consecuencia, este estudio pare- ce demostrar que los beneficios del control glucémico intensivo a largo plazo, en pacientes con una diabetes tipo 2 de inicio, persisten e incluso pueden aumentar con el tiempo. Y sugiere además, la necesidad de un periodo prolongado de hasta 20 años para que sea posible observar los beneficios del tratamiento intensivo sobre las complicaciones car- Meta-análisis recientes sobre los beneficios del control glucémico intensivo en la diabetes tipo 2 Dada la controversia existente sobre los beneficios del control glucémico intensivo sobre las complicaciones macrovas- culares en la diabetes tipo 2, en el último año se han publicado al menos 3 metaanálisis que han intentado clarificar la situación y que se exponen a continuación.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos En el meta-análisis de Ray et al. 14 se incluyeron 5 estudios de intervención, prospectivos y aleatorizados (UKPDS 6,8, AC- CORD 12, ADVANCE 10, VADT 11 y el estudio PROspective pioglitAzone Clinical Trial In macroVascular Events [PROactive] 15), con un total de 33.040 pacientes. La HbA media en el grupo intensivo fue 0,9% más baja que en el grupo conven- cional. El tratamiento intensivo resultó en una reducción del 17% en el número de eventos de infarto de miocardio no fatal (odds ratio 0,83; 95% CI 0,75–0,93), y de un 15% en eventos de enfermedad coronaria (0,85; 95% CI 0,77–0,93). No pudieron demostrarse beneficios en la reducción del riesgo de accidente vascular cerebral (0,93; 95% CI 0,81–1,06) ni en la mortalidad por todas las causas (1,02; 95% CI 0,87–1,19). Los pacientes en tratamiento intensivo tuvieron más epi- sodios de hipoglucemias (38,1% vs. 28,6% en el grupo convencional), más hipoglucemias graves (2,3% vs. 1,2%), y ga- naron una media de 2,5 Kg más que el grupo convencional. Los autores concluyeron que el tratamiento intensivo de la glucemia reducía significativamente los eventos coronarios, sin aumentar el riesgo de muerte. Aunque reconocieron limitaciones, dadas las diferentes características de las poblaciones incluidas en cada estudio, de la distinta duración de los mismos, y las diferentes estrategias terapéuticas utilizadas en cada uno de ellos.
El meta-análisis de Turnbull et al. 16 presenta la ventaja de que en su elaboración contó con la colaboración de los inves- tigadores de los estudios originales recopilados. Se incluyeron 27.049 pacientes correspondientes a los estudios UKPDS 6, ACCORD 12, ADVANCE 10 y VADT 11, con un seguimiento medio de 4,4 años. En este meta-análisis el tratamiento inten- sivo resultó en una reducción de los eventos cardiovasculares mayores del 9% (0,91; 95% CI 0,84–0,99), principalmente por una disminución en el riesgo de infarto de miocardio del 15% (0,85; 95% CI 0,76–0,94). Al igual que en el meta- análisis anterior, no se detectaron beneficios del tratamiento intensivo en la mortalidad global (1,04; 95% CI 0,90–1,20) ni en la mortalidad por causas cardiovasculares (1,10; 95% CI 0,84–1,42). Los pacientes del grupo intensivo tuvieron también mayor número de hipoglucemias graves (2,48; 95% CI 1,91–3,21). Este estudio sugiere un mayor beneficio en la reducción de eventos cardiovasculares mayores en los pacientes sin enfermedad cardiovascular de base (figura 2) y propone una individualización del tratamiento según las características de cada paciente.
Finalmente, en la revisión sistemática de Kelly et al. 17 se seleccionaron 4 estudios (UKPDS 6,8, ACCORD 12, ADVANCE 10 y VADT 11), aunque el UKPDS fue analizado separadamente como UKPDS 33 (sulfonilureas e insulina) 6 y UKPDS 34 (metformina) 8. En este meta-análisis se incluyeron 27.802 pacientes con diabetes tipo 2, y la reducción media de la HbA con el tratamiento intensivo vs. el tratamiento convencional fue de 0,8%. El control intensivo redujo el riesgo de enfermedad cardiovascular en un 10% (0,90; 95% CI 0,83-0,98) y el de enfermedad coronaria en un 11% (0,89; 95% CI 0,81-0,96), a expensas de la disminución de riesgo de infarto de miocardio no fatal del 16% (0,84; 95% CI 0,75-0,94), pero no tuvo efectos beneficiosos sobre la muerte cardiovascular (0,97; 95% CI 0.76-1.24) o la mortalidad total (0,98; 95% CI 0,84-1,15). Así mismo, este tratamiento incrementó el riesgo de hipoglucemia grave en más de 2 veces (2,03; 95% CI 1,46-2,81). Este nuevo meta-análisis confirma las conclusiones de los anteriores. El tratamiento intensivo de la glucemia reduce el riesgo de algunas variables cardiovasculares, especialmente el infarto de miocardio no fatal, pero no disminuye el riesgo de muerte cardiovascular o por todas las causas, y aumenta el riesgo de sufrir hipoglucemias Los resultados más importantes de los 3 meta-análisis referidos anteriormente se resumen en la tabla 2.
LIMITACIONES POTENCIALES DEL CONTROL GLUCÉMICO INTENSIVO
Fijar un nivel estricto de HbA para todos los pacientes con diabetes puede suponer una limitación importante. El es- tudio ACCORD demostró que, en determinados pacientes, reducir los niveles de HbA hasta valores normales (<6,5%) puede asociarse a una supervivencia disminuida12. Recientemente, se ha publicado un análisis retrospectivo de 2 co- hortes de pacientes con diabetes tipo 2, con una edad ≥50 años, evaluando la supervivencia en función de los niveles de HbA 18. En este estudio se incluyeron por una parte 27.965 pacientes, cuyo tratamiento fue intensificado de mono- terapia oral a terapia combinada (cohorte 1), y por otra, 20.005 pacientes, cuyo tratamiento fue intensificado incluyen- do insulina (cohorte 2). Utilizando modelos Cox de supervivencia, ajustados respecto a la edad, sexo, tabaquismo, nivel de colesterol, riesgo cardiovascular y morbilidad general, se evaluó la mortalidad por todas las causas en las 2 cohortes en función de los niveles de HbA , expresados en decilos. El riesgo de mortalidad total fue de 1,52 (95% CI 1,32–1,76) en el decilo de HbA inferior (mediana de HbA 6,4%), y de 1,79 (95% CI 1,56–2,06) en el decilo superior (mediana de HbA 10,5%). En ambos cohortes pudo demostrarse una curva en U, con el riesgo menor correspondiente a un nivel de HbA de 7,5% (figura 3). La mortalidad por todas las causas fue superior en los pacientes en tratamiento con insu- lina frente a los que recibieron tratamiento combinado oral (1,49, 95% CI 1,39–1,59), lo que podía reflejar una diabetes de mayor gravedad en los pacientes que reciben insulina. Este trabajo no permite analizar las causas de muerte en las cohortes analizadas. Es sabido que el tratamiento con insulina y sulfonilureas incrementan el riesgo de hipoglucemias graves, que quizás pudieran haber sido un factor relevante. Estos datos sugieren que tanto los valores elevados como muy bajos de HbA parecen asociarse con una mortalidad elevada y, probablemente, mayor número de episodios cardiovasculares. En consecuencia, estos factores deben ser tomados en cuenta en la individualización de los objetivos Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos IMPLICACIONES PARA LA PRACTICA CLÍNICA
La controversia suscitada tras la publicación de los resultados del ACCORD 12, ADVANCE 10 y VADT 11 acerca de los efectos potenciales del control intensivo de la glucemia sobre la prevención cardiovascular ha conducido a diversas sociedades científicas a realizar un posicionamiento sobre el tema. Destaca en particular el posicionamiento conjunto de la Ameri- can Diabetes Association (ADA), la American College of Cardiology Foundation (ACCF) y la American Heart Association (AHA), que ha sido publicado íntegramente en diversas fuentes 19,20,21. Tal como se destaca en el documento, debido al diseño de los estudios analizados no ha sido posible encontrar, a pesar de los múltiples post-hoc análisis realizados, una o varias causas responsables de los efectos observados. La intensifi- cación del tratamiento se tradujo en una mayor frecuencia de hipoglucemias graves, mayor uso de insulina, glitazonas, otros fármacos y combinaciones de todos ellos, además de una mayor ganancia ponderal. Algunos de estos factores han sido asociados estadísticamente con una mayor mortalidad en el grupo intensivo, pero podrían no ser los agentes causales. Como hipótesis, una hipoglucemia grave podría desencadenar un episodio fatal en una persona susceptible de alto riesgo cardiovascular. También el incremento de peso excesivo, las interacciones medicamentosas no deseadas (ni sospechadas) o una reducción excesivamente intensa de la HbA podrían haber jugado algún papel en la mayor morta- lidad del grupo intensivo, observada en el ACCORD. Entre las causas evaluadas que justifiquen la ausencia de efectos beneficiosos del tratamiento intensivo sobre la enfer- medad cardiovascular de los pacientes con diabetes tipo 2, a diferencia de diversos estudios epidemiológicos previos y de los resultados conocidos del Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) 22, destacan las siguientes: • Menor morbimortalidad cardiovascular en el grupo convencional del inicialmente previsto, debido a un mayor uso en pacientes de alto riesgo de estatinas, antihipertensivos y aspirina.
• Tamaño muestral insuficiente y/o duración escasa del periodo de intervención.
• Diferencias relativamente pequeñas en la HbA entre los grupos intensivo vs. convencional (6,4-6,9% vs. 7,0- • Selección de pacientes con "alto riesgo", con una diabetes de >8 años de duración, enfermedad cardiovascular conocida o múltiples factores de riesgo. Los efectos beneficiosos del tratamiento intensivo observados en el UKPDS-Post Trial Monitoring 13 y en el DCCT/EDIC 22 sugieren que tan sólo un control intensivo al inicio de la enfer- medad puede ser de utilidad. En consecuencia, cuando la enfermedad cardiovascular se halla presente no deben de esperarse grandes ventajas del tratamiento intensivo.
• Las estrategia terapéuticas actuales para la hiperglucemia en pacientes con diabetes tipo 2 son responsables tam- bién de algunos efectos indeseables como las hipoglucemias o el aumento de peso, que podrían haber mitigado los beneficios del mejor control glucémico en el grupo intensivo.
Con estas consideraciones previas, el documento de posicionamiento de la ADA-ACCF-AHA introduce una serie de impli- caciones importantes para la práctica clínica que deben mencionarse separadamente: • Los beneficios del tratamiento intensivo de la hiperglucemia están firmemente establecidos en la prevención de la aparición/progresión de las complicaciones microangiopáticas en la diabetes tipo 1 y tipo 2, tal como además se ha podido confirmar en el estudio ADVANCE.
• En la diabetes tipo 2, el control de otros factores de riesgo (hipertensión arterial, dislipidemia, hipercoagulabili- dad, obesidad) representa la mejor estrategia preventiva de la enfermedad cardiovascular.
• Las evidencias sobre el beneficio cardiovascular del tratamiento intensivo son sólidas en la diabetes tipo 1, y este tratamiento parece ser también beneficioso en los pacientes con diabetes tipo 2 de corta duración de la enferme- dad y/o sin enfermedad cardiovascular establecida.
• Se recomienda reducir la HbA hasta ≤7% para prevenir la aparición o evitar la progresión de las complicaciones microangiopáticas, en los pacientes con diabetes tipo 1 y tipo 2 (nivel de evidencia A).
• También se recomienda un nivel de HbA ≤7% en la prevención de la enfermedad macrovascular en diabetes tipo 1 y en pacientes con diabetes tipo 2 al inicio del diagnóstico (nivel de evidencia A).
• Deben de individualizarse los objetivos en función de cada paciente. En pacientes con diabetes tipo 2 con du- ración escasa de la enfermedad, larga expectativa de vida, y ausencia de enfermedad cardiovascular, se sugiere mantener el objetivo de control de HbA ≤7% (nivel de evidencia C). En otras circunstancias, en pacientes con larga duración de la enfermedad, historia previa de hipoglucemias graves, expectativa de vida limitada, enferme- dad microvascular avanzada, enfermedad cardiovascular presente y/o presencia de otras co-morbilidades graves se recomiendan objetivos menos estrictos (nivel de evidencia C).
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos En esta línea, recientemente, la Australian Diabetes Society 23 ha elaborado un documento sobre individualización de los objetivos terapéuticos para adultos con diabetes, cuyas recomendaciones se resumen en la tabla 3. POSICIONAMIENTO ACTUAL DE LA ROSIGLITAZONA EN EL TRATAMIENTO DE LA DIABETES MELLITUS
TIPO 2. ULTIMAS EVIDENCIAS
Las glitazonas (rosiglitazona, pioglitazona) incrementan la sensibilidad a la insulina a nivel del hígado, músculo y tejido adiposo. Tienen una eficacia comparable a la metformina y a las sulfonilureas, y al igual que la metformina no producen hipoglucemia. Frente a la monoterapia con metformina o glibenclamida, el tratamiento con rosiglitazona fue superior al mantener un adecuado control glucémico durante más tiempo 24. Los efectos secundarios más frecuentes son el edema, la ganancia de peso y la anemia. El edema es raro (< 5%) y frecuentemente asociado al tratamiento con sulfonilureas o insulina. La ganancia de peso es variable, aunque menor en combinación con metformina. La anemia es dilucional y de escasa repercusión clínica. Debido al riesgo de retención hídrica, estos fármacos están contraindicados en los pacientes con insuficiencia cardiaca congestiva moderada o grave (clases III y IV de la clasificación de la New York Heart Associa- tion (NYHA)). Recientemente, se ha comunicado un mayor riesgo, aunque marginal, de fracturas distales en miembros superiores o inferiores con rosiglitazona, aunque sólo en mujeres, pero no en hombres ni en otras localizaciones 24. La relevancia clínica de estos hallazgos, también observados con pioglitazona, está por demostrar.
En base a los efectos favorables sobre la hiperglucemia y otros factores de riesgo cardiovascular, clásicos y no clásicos, se ha sugerido que estos fármacos podrían reducir el riesgo cardiovascular. En el estudio PROactive, en un grupo de pa- cientes con diabetes tipo 2 y enfermedad cardiovascular avanzada, la pioglitazona no demostró beneficios significativos frente a placebo en la variable principal, aunque sí una reducción significativa del 16% en una variable secundaria fuerte (muerte, infarto de miocardio no fatal o accidente vascular cerebral) 15. Sin embargo, en 2007, Nissen y Wolski publicaron un controvertido meta-análisis que intentó sembrar algunas dudas acerca de un posible incremento del riesgo de infarto de miocardio en los pacientes tratados con rosiglitazona 25. Estos datos no fueron confirmados en un análisis preliminar y no previsto del estudio RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes), después de 3,75 años de seguimiento 26. El RECORD fue un estudio de intervención abierto, aleatorizado, multicéntrico y a largo plazo, que pretendía evaluar la frecuencia de eventos cardiovasculares en pacientes con diabetes tipo 2 tratados con rosiglitazona, en combinación con metformina o sulfonilurea, frente a pacientes tratados con metformina y sulfonilureas. Tras la finalización del estudio, después de una media de 5,5 años, se confirmó que rosiglitazona no aumentaba la morbilidad cardiovascular, incluido el riesgo de infarto de miocardio, ni la mortalidad en comparación con otros agentes orales de uso habitual 27. No obstante, este estudio confirmó un mayor riesgo de insuficiencia cardiaca (HR 2,10, 95% CI 1,35–3,27), y del algunos tipos de fracturas, principalmente en mujeres. Tampoco el estudio BARI-2D (The Bypass Angioplasty Revascularization Investigation 2 Diabetes), en el se comparaba la revascularización precoz vs. el tratamiento médico intensivo en pacientes con diabetes tipo 2 y enfermedad coronaria pudo demostrar efectos deletéreos en los pacientes tratados con rosiglitazona 28. Hay que tener en cuenta, que en este estudio los pacientes que recibieron tratamiento médico intensivo fueron aleatorizados, además, a un tratamiento insu- lin-sensibilizador, de los cuales hasta un 55,1% recibieron rosiglitazona, o a una terapia basada en el aporte de insulina. Por todo ello, sorprende la actitud de algunos expertos contraria al uso de la rosiglitazona en el tratamiento de la diabe- tes tipo 2. En particular, destaca el posicionamiento de alguno de ellos en los algoritmos de la ADA-EASD (European As- sociation for the Study of Diabetes). Desde la revisión del primer algoritmo ADA-EASD en Noviembre 2007, publicada en Enero de 2008 29, es conocida la opinión contraria de este grupo de expertos al uso de rosiglitazona en la diabetes tipo 2. Sin embargo, la prudencia demostrada en dicha revisión contrasta con el posicionamiento frontal en la última revisión de este documento contra la rosiglitazona 30, sin que hayan aparecido desde entonces datos nuevos que puedan justificar este cambio de actitud. A pesar de que los autores reconocen la falta de datos concluyentes sobre el riesgo cardiovas- cular potencial asociado a rosiglitazona, estos expertos se posicionan "unanimously advised against using rosiglitazone" 30. Tampoco resulta coherente ni razonable que estos expertos destaquen con vehemencia el uso de pioglitazona (frente a la rosiglitazona), especialmente en la figura que resume el algoritmo, a pesar de reconocer que los datos disponibles son "less than conclusive for … a cardiovascular disease benefit with pioglitazone 30. Tampoco los datos recientes del ACCORD 12 o del VADT11 parecen confirmar un incremento de riesgo de mortalidad asociado al uso de rosiglitazona. La diabetes tipo 2, especialmente en caso de hiperglucemia no controlada, se asocia con frecuencia con el desarro- llo complicaciones crónicas micro- y macrovasculares, y un mayor riesgo de muerte por causas cardiovasculares. Los beneficios del control intensivo de la glucemia sobre la prevención de la aparición/progresión de las complicaciones Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos microvasculares son incuestionables, tanto en los pacientes con diabetes tipo 1 y diabetes tipo 2. Sin embargo, el papel de la reducción de la hiperglucemia en la prevención de las complicaciones macrovasculares parece más controvertido. Actualmente, se recomienda alcanzar niveles casi normales de HbA (≤6,5-7%) tan sólo en pacientes con diabetes tipo 1 y en pacientes con diabetes tipo 2 con diabetes de corta duración y sin enfermedad cardiovascular. En pacientes con diabetes tipo 2 de largo tiempo de evolución, con complicaciones microangiopáticas graves o enfermedad cardiovas- cular, los objetivos de control glucémico deben individualizarse y ser menos ambiciosos, evitando en todo lo posible la aparición de hipoglucemias. En estos pacientes, debe intensificarse sobre todo el control de la tensión arterial y de la dislipidemia, y promoverse el uso de la aspirina. En consecuencia, se debe promover un control efectivo y precoz de la hiperglucemia crónica al inicio de la diabetes tipo 2, intentando flexibilizar la terapia para conseguir el mantenimiento de los objetivos glucémicos (figura 4). Los beneficios del control intensivo de la glucemia en estos pacientes pueden tardar años ( 20 años) en ser reconocidos (efecto lega- do). Mientras que no parecen ser beneficiosos, o incluso son perjudiciales, en aquellos con enfermedad cardiovascular ABDENDUM: Con fecha 23 de Septiembre la EMEA ha decidido suspender la comercialización de todas las especialidades que contienen rosiglitazona como principio activo (Avandia, Avandamet y Avaglim), dado que considera que los bene- ficios del fármaco no superan los posibles riesgos. En este contexto, la FDA ha decidido mantener su comercialización, pero ha propuesto una serie de medidas de farmacovigilancia. Este último organismo considera que son controvertidos y no definitivos los datos sobre un posible incremento de riesgo cardiovascular asociado a rosiglitazona. Se ha solicitado una verificación independiente de los resultados del estudio RECORD.
Tabla 1. Estudios de intervención en pacientes con diabetes tipo 2 con enfermedad cardiovascular o con elevado
riesgo cardiovascular
ACCORD 12 (n=10,250)
ADVANCE 10 (n=11,140)
MI, stroke, death from CV causes, new or worsening Non-fatal MI, non-fatal stroke, Non-fatal MI, non-fatal stroke, CHF, revascularisationb and inoperable CAD, amputation for ischaemic gangrene HR (95% CI) for primary
0.90 (0.78–1.04) 0.94 (0.84–1.06) 0.87 (0.730–1.04) HR (95% CI) for mortality
1.22 (1.01–1.46)b 0.93 (0.83–1.06) 1.065 (0.801–1.416) a Conventional vs. intensive therapy; b p=0.04; CAD, coronary artery disease; CHF, congestive heart failure; CVD, cardiovascular disease; MI, myocardial infarction Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Tabla 2. Meta-análisis recientes sobre los beneficios del control glucémico intensivo en la diabetes tipo 2
Ray, et al. 14
Turnbull, et al. 16 2009
Kelly, et al. 17
No. of patients
10% major CV outcomes 17% non-fatal MI 9% major CV outcomes 16% non-fatal MI 15% non-fatal MI Main Results
ect on CV mortality ect on CV mortality ect on all-cause ect on all-cause ect on all-cause e hypos (38.1% vs. Undesirable effects
e severe hypos (2.3% e severe hypos (2.48 e severe hypos (2.03 (intensive vs. conventional)
e weight gain (+ 2.5 Tabla 3. Objetivos recomendados de HbA para adultos con diabetes tipo 2. Australian Diabetes Society Position
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos a. Conseguir los objetivos de HbA debe balancearse frente al riesgo de hipoglucemias graves, especialmente en b. En el paciente adulto, una diabetes de larga duración se considera cuando es >10-20 años, pero en el caso de un paciente con diabetes tipo 2 que debuta en edades tempranas, este periodo puede ser considerablemente mayor.
c. Como ejemplos de co-morbilidades puede considerarse la enfermedad renal crónica (estadios 4-5), la insuficien- cia cardiaca NYHA III-IV, un neoplasia incurable o una demencia moderada-grave.
d. Conseguir glucemias < 270 mg/dL para minimizar el riesgo de infección.
• Figura 1. Cambios en la HbA en los primeros 5 años del UKPDS-Post Trial Monitoring 13.
• • Figura 2. Beneficio del tratamiento intensivo de la glucemia sobre la aparición de nuevos eventos cardiovascula- res mayores según existencia previa de enfermedad macrovascular. Modificado de Turnbull et al.16 • • Figura 3. Hazard ratio ajustada para mortalidad por todas las causas según los niveles de HbA , en pacientes dia- béticos en tratamiento combinado oral o en tratamiento con insulina. Modificado de Currie et al.18 • • Figura 4. Representación hipotética del efecto de la hiperglucemia crónica en la historia natural de la diabetes tipo 2, en pacientes reclutados en el estudio VADT. Modificado de Del Prato et al.32 Pies de figuras:
Figura 1.
Las diferencias observadas en la hemoglobina glicosilada entre los grupos de tratamiento se perdieron después del primer año después de la finalización del estudio de intervención (1997). Figura 2.
La terapia intensiva de la hiperglucemia puede ser útil en la prevención de la enfermedad cardiovascular en pacientes sin enfermedad cardiovascular previa. Figura 3.
A. Tratamiento combinado de metformina y sulfonilureas. B. Tratamientos con insulina. Se utilizó un modelo Cox proporcional de riesgo con la HbA como escenario. Figura 4.
La línea de puntos superior representa la evolución de la HbA , estimada en función de los datos del UKPDS 6. La línea de puntos inferior simboliza el nivel ideal de HbA . La línea continua indica la evo- lución de la HbA en el estudio VADT 11.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 1. Gerich JE. Contributions of insulin-resistance and insulin-secretory defects to the pathogenesis of type 2 diabe- tes mellitus. Mayo Clin Proc 2003; 78:447-56. 2. Monnier L, Colette C. Glycemic Variability. Should we and can we prevent it? Diabetes Care 2008; 31:S150-S154. 3. Ceriello A. New Insights on Oxidative Stress and Diabetic Complications May Lead to a "Causal" Antioxidant The- rapy. Diabetes Care 2003; 26:1589-96. 4. Reichard P, Nilsson BY, Rosenqvist U. The effect of long-term intensified insulin treatment on the development of microvascular complications of diabetes mellitus. N Engl J Med 1993; 329:304-9. 5. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329:977-86. 6. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352:837-53. 7. Ohkubo Y, Kishikawa H, Araki E, Miyata T, Isami S, Motoyosyi S, et al. Intensive insulin therapy prevents the pro- gression of diabetic microvascular complications in japanese patients with non-insulin-dependent diabetes mellitus: a randomized prospective 6-year study. Diabetes Res Clin Pract 1995; 28:103-17. 8. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352:854-65. 9. Stratton IM, Adler AI, Neil HAW, Matthews DR, Manley SE, Cull CA, et al. Association of glycaemia with macrovas- cular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. B M J 2000; 321:405-12. 10. The ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358:2560-72. 11. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD, et al. Glucose control and vascular complica- tions in veterans with type 2 diabetes. N Engl J Med 2009; 360:129. 12. The Action to Control CardiovascularRisk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 258:2545-59. 13. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HAW. 10-Year Follow-up of Intensive Glucose Control in Type 2 Diabetes. N Engl J Med 2008; 359:1577-89. 14. Ray KK, Seshasai SR, Wijesuriya S, Sivakumaran R, Nethercott S, Preiss D, et al. Effect of intensive control of glu- cose on cardiovascular outcomes and death in patients with diabetes mellitus: a meta-analysis of randomised controlled trials. Lancet 2009; 373:1765-72. 15. Dormandy JA, Charbonnel B, Eckland DJ, Erdman E, Massi-Benedetti M, Moules IK, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366:1279-89. 16. Turnbull FM, Abraira C, Anderson RJ, Byington RP, Chalmers JP, Duckworth WC, et al. Intensive glucose control and macrovascular outcomes in type 2 diabetes. Diabetologia 2009; 52:2288-98. 17. Kelly TN, Bazzano LA, Fonseca VA, Thethi TK, Reynols K, He J. Systematic review: glucose control and cardiovascu- lar disease in type 2 diabetes. Ann Intern Med 2009; 151:394-403. 18. Currie CJ, Peters JR, Tynan A, Evans M, Heine RJ, Bracco OL, et al. Survival as a function of HbA(1c) in people with type 2 diabetes: a retrospective cohort study. Lancet 2010; 375:481-9. Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 19. Skyler JS, Bergenstal R, Bonow RO, Buse J, Deedwania P, Gale EA, et al. Intensive glycemic control and the pre- vention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position sta- tement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Diabetes Care 2009; 32:187-92. 20. Skyler JS, Bergenstal R, Bonow RO, Buse J, Deedwania P, Gale EA, et al. Intensive glycemic control and the pre- vention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position sta- tement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Circulation 2009; 119:351-7. 21. Skyler JS, Bergenstal R, Bonow RO, Buse J, Deedwania P, Gale EA, et al. Intensive glycemic control and the pre- vention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA Diabetes Trials: a position sta- tement of the American Diabetes Association and a Scientific Statement of the American College of Cardiology Foundation and the American Heart Association. J Am Coll Cardiol 2009; 53:298-304. 22. Nathan DM, Cleary PA, Backlund JY, Genuth SM, Lachin JM, Orchard TJ, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353:2643-53. 23. Cheung NW, Conn JJ, d'Emden MC, Gunton JE, Jenkins AJ, Ross G, et al. Position statement of the Australian Dia- betes Society: individualisation of glycated haemoglobin targets for adults with diabetes mellitus. MJA 2009; 24. Kahn SE, Haffner SM, Heise MA, Herman WH, Holman RR, Jones NP, et al. Glycemic durability of rosiglitazone, me- tformin, or glyburide monotherapy. N Engl J Med 2006; 355:2427-43. 25. Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 256:2457-71. 26. Home PD, Pocock SJ, Beck-Nielsen H, Gomis R, Hanefeld M, Jones NP, et al. Rosiglitazone evaluated for cardiovas- cular outcomes - an interim analysis. N Engl J Med 2007; 357:28-38. 27. Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M, et al. Rosiglitazone evaluated for cardio- vascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet 2009; 373:2125-35. 28. The BARI 2D Study Group. A Randomized Trial of Therapies for Type 2 Diabetes and Coronary Artery Disease. N Engl J Med 2009; 360:2503-15. 29. Nathan DM, Buse JB, Davidson MB, Ferrannini E, Holman RR, Sherwin R, et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: update regarding thiazolidi- nediones. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2008; 31:173-5. 30. Nathan DM, Buse JB, Davidson MB, Ferrannini E, Holman RR, Sherwin R, et al. Medical Management of Hyper- glycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabe- tes Care 2009; 32:193-203. 31. The Australian Diabetes Society. Australian Diabetes Society Position Statement: Individualization of HbA1c Targets for Adults with Diabetes Mellitus. http://www diabetessociety com au/downloads/positionstatements/ HbA1ctargets pdf 2009. 32. Del Prato S. Megatrials in type 2 diabetes. From excitement to frustration? Diabetologia 2009; 52:1219-26. Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos La hipertensión arterial (HTA) es un factor de riesgo muy frecuentemente asociado a la diabetes mellitus (DM), depen- diendo su prevalencia del tipo de diabetes, de la edad, del peso y de la raza; y es la responsable del 85% del riesgo cardiovascular global de estos pacientes. Está claramente establecido que la coexistencia de HTA y DM incrementa sus- tancialmente el riesgo de enfermedad renal o daño de otros órganos, de tal manera duplica el riesgo de desarrollar una complicación cardiovascular en forma de enfermedad coronaria, insuficiencia cardiaca congestiva, arteriopatía periférica o ictus cerebral y multiplica por cinco el riesgo de progresión a una insuficiencia renal terminal1. Es por ello, que el control integral de los factores de riesgo vascular asociado a los pacientes diabéticos, es fundamental para mejorar su pronóstico y prevenir o enlentecer el desarrollo de enfermedades cardiovasculares (ECV).
El mecanismo fisiopatológico implicado en el desarrollo de HTA defiere para el diabético tipo 1 o el diabético tipo 2. En el DM tipo 1, la HTA habitualmente es secundaria a una nefropatía, inicialmente subclínica (mediada por el incremento de la secreción urinaria de albúmina), que lentamente evoluciona a proteinuria manifiesta y progresión a insuficiencia renal, mientras que en el diabéticos tipo 2, la HTA esencial, que ya encuentra presente en un tercio de estos pacientes en el momento de su diagnóstico, generalmente se asocia a otros trastornos metabólicos, como el sobrepeso, la hiperinsu- linemia o la dislipemia aterogénica que sinérgicamente participan en el desarrollo y progresión hacia una enfermedad micro y macrovascular generalizada.
En general, la HTA asociada a los pacientes diabéticos se caracteriza por una serie de mecanismos fisiopatológicos y me- tabólicos específicos (Tabla 1), que la diferencian de la HTA asociada a la población general. Conocer estas peculiaridades es importante por la aplicación práctica que puede tener en la elección del tratamiento farmacológico.
Tabla 1: Mecanismos fisiopatológicos característicos de la HTA en el paciente diabético
• Mayor sensibilidad a la sal y expansión del volumen plasmático• Aumento del tono simpático• Ausencia del descenso nocturno de la PA• Marcado papel pronóstico de la microalbuminuria• Incremento de la rigidez arterial DESPISTAJE Y DIAGNÓSTICO
La Asociación Americana de Diabetes (ADA)2 recomienda medir la presión arterial (PA) en cada visita rutinaria de control del paciente diabético, dada la elevada prevalencia de HTA asociada a estos pacientes. La toma de esta PA en la clínica debe realizarse por personal entrenado y siguiendo las recomendaciones de las guías en cuanto a la metodología de la toma de la PA establecidas para toda la población: medir la PA con el paciente sentado con el brazo a la altura del corazón y tras 5 minutos de reposo. Dado el alto riesgo cardiovascular que se asocia a los pacientes diabéticos con HTA, la cifra de PA que define HTA en el paciente diabético PA ≥ 130/80 mmHg) es inferior a la establecida para la población general (PA ≥ 140/90 mmHg). Aquellos pacientes en los que se constata unas cifras de PAS ≥ 130 mmHg o PAD ≥ 80 mmHg, éstas deben confirmase en otra visita. Unas cifras repetidas de PAS ≥ 130 mmHg o PAD ≥ 80 mmHg confirman del diagnóstico de HTA (C)2. Recientemente la Sociedad Europea de Hipertensión (ESH), en su revisión del 2009,ha establecido el punto de corte para el tratamiento de la HTA en cifras de PA iguales o superiores a 140/90 mmHg3 De cara a mejorar el diagnóstico y manejo del paciente con HTA, no hay que olvidar que la implantación de nuevas técni- cas de medida de la PA, como toma de la PA en el domicilio o mediante una monitorización ambulatoria de la PA (MAPA), contribuyen de forma clara a una mejor estratificación del riesgo cardiovascular y por tanto mejor manejo terapéutico de los pacientes hipertensos. Si bien estas técnicas presentan una mejor correlación con el riesgo cardiovascular que la toma de la PA clínica4-5. En general no hay un punto de corte especifico para diagnosticar de hipertenso al paciente diabético, por lo que se deben de seguir los criterios generales descritos para las técnicas de AMPA y MAPA. Actualmente el benefi- cio del tratamiento antihipertensivo en los pacientes diabéticos sigue basándose en la toma de la PA en la consulta2. OBJETIVOS DE PRESIÓN ARTERIAL
Las recomendaciones de la ADA del 20102 en cuanto a los objetivos de control de la PA en los pacientes diabéticos son Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos • Los pacientes diabéticos deben recibir tratamiento hasta alcanzar cifras de PAS < 130 mmhg (C) • Los pacientes diabéticos deben recibir tratamiento hasta alcanzar cifras de PAD < 80 mmHg (B).
Sin embargo, merece la pena puntualizar que las últimas recomendaciones de la ESH3 en cuanto a los objetivos de con- trol de la PA en el paciente diabético no son tan "estrictas". En este sentido se establece que si bien el tratamiento anti- hipertensivo debería iniciarse siempre en aquellos pacientes con cifras de PA ≥ 140/90 mmH, el inicio del tratamiento
antihipertensivo en el rango de las cifras de PA normal-alta (130-139/80-89 mmHg) no cuenta con la suficiente evidencia científica por el momento. En estos pacientes, se podría recomendar iniciar el tratamiento antihipertensivo, particular- mente en aquellos pacientes que presenten microalbuminuria, basándose en las evidencias sobre el efecto favorable que el tratamiento antihipertensivo ejerce en la regresión y enlentecimiento en la progresión de la lesión orgánica silente.
La guía ESH3 promueve que el objetivo de tradicional de PA < 130/80 mmHg tampoco se sustenta con las evidencias de los ensayos clínicos actuales, y además es un objetivo difícil de alcanzar en la mayor parte de los pacientes. Por tanto, una opción más realista es recomendar reducir las cifras de PAS entre 130-139 mmHg, y si es posible, alcanzar los niveles de
PA más cercanos a PAS 130 mmHg, pero no PAS < 120 mmHg3. Nuevas evidencias como las del estudio Action to control Cardiovascular Risk in Diabetes-Blood Pressure (ACCORD –BP)6 que incluyó a 4.733 pacientes con diabetes mellitus tipo2. En este estudio los pacientes fueron aleatorizados a una te- rapia intensiva con objetivo de control de PAS < 120 mmHg versus una terapia estandar con cifras de PAS < 140 mmHg. Este estudio demostró que disminuir las cifras de PAS < 120 mmHg en pacientes diabéticos con elevado riesgo de ECV, no reducía significativamente el objetivo primario de infarto de miocardio, ictus o muerte de origen cardiovascular (HR 0,88; IC 95%, 0,73-1,06; p=0,20) frente a disminuir la PAS < 140 mmhg. En esta misma línea se encuentran los datos reciente- mente publicados sobre un análisis observacional de un subgrupo de 6.400 pacientes, mayores de 50 años, hipertensos, diabéticos y con enfermedad coronaria incluidos en el International Verapamil SR-Trandolapril Study (INVEST) en los que por primera vez se demuestra que disminuir las cifras de PAS < 130 mmHg en pacientes diabéticos con enfermedad co- ronaria no sólo no comporta una mayor reducción de la morbilidad cardiovascular que mantener las cifras de PAS < 140 mmHg, si no que demás se asocia con un incremento significativo de la mortalidad por cualquier causa (HR 1,15; IC 95%, 1,01-1,32 ; p=0,04)7. EVIDENCIAS SOBRE EL BENEFICIO DEL TRATAMIENTO ANTIHIPERTENSIVO
Desde hace años se conoce el beneficio que el tratamiento antihipertensivo aporta a los pacientes con DM en térmi- nos de reducción de la morbimortalidad cardiovascular. Ya el estudio Systolic Hypertension in The Elderly Program (SHEP)8demostró cómo el tratamiento con dosis bajas de clortalidona reducía significativamente las complicaciones car- diovasculares frente a placebo en una población anciana con DM tipo 2. Posteriormente otros estudios como el Systolic- hypertension in Europe (Syst-Eur)9 Trial observaron resultados similares en el subgrupo de pacientes diabéticos tras 5 años de tratamiento con una terapia basada en nitrendipino frente a placebo.
Ante dicha evidencia surge una nueva hipótesis: ¿una reducción mayor de la PA comportará un mayor beneficio vascu- lar?. Con dicho objetivo se diseñó el estudio Hypertension Optimal treatment Study (HOT)10 que incluyó a un subgrupo de 1.501 pacientes hipertensos con DM tipo 2, en un análisis post hoc de este subgrupo, los pacientes que alcanzaron reducciones mayores de las cifras de PAD mostraron significativamente (p=0,005) menor incidencia de eventos cardio- vasculares. Estos resultados se confirmaron en el United Kingdom Prospective Diabetes Study (UKPDS)11 en el que un control más estricto (PA<150/85 vs <180/105) de la PA redujo un 24% las complicaciones asociadas a la DM tipo2, un 32% la mortalidad asociada a la diabetes, un 44% la incidencia de ictus y un 37% la enfermedad microvascular. El seguimiento a los 8 años de 1.148 pacientes hipertensos con DM confirmó que una reducción precoz y enérgica de las cifras de PA, independientemente del régimen terapéutico utilizado, se asociaba a un menor riesgo de complicaciones micro y ma- crovasculares, especialmente en la prevención del ictus y la retinopatía12. Si bien algunos estudios posteriores como el Losartan Intervention For endpoint redcution (LIFE)13 trial que incluyó a 1.195 pacientes con HTA, DM y signos de hipertrofia ventricular izquierda(HVI) por electrocardiograma, observaron dife- rencias significativas en cuanto a reducción de la mortalidad por cualquier causa a favor del régimen basado en losartan frente a atenolol (%% 0,61; IC 95% 0,45-0,84; p=0,002) , estudios posteriores no confirman que exista realmente una di- ferencia entre "clases", y que el beneficio del tratamiento antihipertensivo se atribuye principalmente al descenso "per se" de las cifras de PA y no a los efectos inherentes a una específica molécula o clase antihipertensiva.
En esta línea nos encontramos los resultados del estudio Antihypertensive and Lipid-Lowering treatment to Prevent Heart Attack Trial ( ALLHAT )14, en el que, a pesar de las limitaciones inherentes a su diseño, el subgrupo de 12.063 pacientes con DM mostró resultados similares en cuanto al objetivo primario de eventos cardiovasculares con las tres ramas de trata- miento (clortalidona, lisinopril o amlodipino) o el estudio Intervention as a Goal in hypertension treatment (INSIGHT)15 en Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos el que el tratamiento con Nifedipino GITS en el subestudio de 1.302 pacientes diabéticos no mostró diferencias en cuanto a eventos cardiovasculares entre las diferentes ramas de tratamiento.
Cómo hemos comentado anteriormente, presentar cifras de PA ≥ 130/80 mmHg es muy frecuente en el conjunto de la población diabética, lo cual incrementa sustancialmente su riesgo cardiovascular total, situando a estos pacientes en una escala de riesgo vascular alto o muy alto. En estos pacientes, la combinación de 2 o más fármacos antihipertensivos con distinto mecanismo de acción se hace muy necesaria para poder alcanzar el objetivo de PA recomendado por las diferen- tes guías, dado que permite un mayor descenso de las cifras de PA que el conseguido por cada uno de ellos en monotera- pia6. En esta línea son interesantes las reflexiones que el estudio ADVANCE16 aporta para el manejo del paciente diabético. Este estudio la adicción de una terapia combinada de un IECA (perindopril) con un diurético (indapamida) sobre una terapia antihipertensiva previa en pacientes diabéticos, se asocio con una reducción significativa (9%) de las complica- ciones micro y macrovasculares, una reducción del 14% de la mortalidad por cualquier causa y una reducción del 21% de las complicaciones renales, tales como proteinuria, microalbuminuria, duplicación de las cifras de creatinina sérica, diálisis o transplante renal. Los resultados de este estudio se ven reforzados por los datos del estudio ACCOMPLISH17 (60% diabéticos) en el que una combinación fija de benazepril y calcioantagonista (amlodipino) redujo un 20% el riego relativo de la aparición de complicaciones cardiovasculares, frente a la combinación benazepril e hidroclorotiazida.
Si bien las complicaciones microvasculares asociadas a la diabetes parecen tener una relación con el control de las cifras de PA, los beneficios del tratamiento antihipertensivo no parecen tener los mismos efectos a nivel de nefropatía, neuro- patía o retinopatía diabética. A pesar que los datos del UKPDS mostraron una reducción en la incidencia de retinopatía diabética asociada a un control estricto de las cifras de PA, este efecto no se ha corroborado totalmente en los estudios más recientes como en estudio ADVANCE donde el conjunto de eventos macro y microvasculares si presenta una dife- rencia estadísticamente significativa pero no el análisis de ambos por separado. En el estudio DIRECT18 realizado sobre pacientes normotensos con DM tipo 1, el tratamiento con un ARA 2 no mostró un efecto beneficioso sobre la retinopatía diabética, si bien algunos autores defienden que su efecto negativo se atribuye a que, a diferencia de la población del UKPDS, estos pacientes presentaban una retinopatía muy establecida.
En resumen, la evidencia científica demuestra que el tratamiento antihipertensivo en los pacientes diabéticos induce una protección cardiovascular y disminuye la aparición de complicaciones cardiovasculares, que se atribuye principalmente al descenso "per se" de las cifras de PA. Si bien, hasta el momento no hay suficientes datos que muestren diferencias entre las diversas clases de antihipertensivos en cuanto a la reducción de eventos cardiovasculares, los datos aportados por diversos estudios avalan a las diversas guías terapéuticas a recomendar el uso de fármacos bloqueantes del SRA, como fármacos de primera línea, por su demostrado efecto nefroprotector. Finalmente es indudable que para conseguir una mayor reducción de las complicaciones microvasculares en los pacientes diabéticos es necesaria un control sinérgico de los valores de glucosa y de PA, si bien el efecto del tratamiento antihipertensivo a nivel de la neuropatía y /o retinopatía diabética es, hasta el momento, poco consistente. ESTRATEGIAS DE TRATAMIENTO
(grado de recomendación de la ADA).
• Si bien no hay datos sobre ensayo clínicos aleatorizados sobre el efecto de la dieta y el ejercicio para reducir las ci- fras de PA en pacientes diabéticos, estudios en población no diabética han demostrado efectos antihipertensivos similares a la monoterapia. Estos efectos se basan en reducir peso en los pacientes en los que existe sobrepeso y los efectos atribuidos a la dieta DASH: reducir de la ingesta de sodio e incrementar el potasio mediante la ingesta de frutas y vegetales, disminuir la ingesta de grasas, prohibir el consumo excesivo de alcohol e incrementar la actividad física 19-20 (B).
• Los pacientes con cifras de PAS entre 130-139 mmHg o PAD entre 80-89 mmHg, se recomienda iniciar cambios en el estilo de vida durante 3 meses, y si no se alcanzan los objetivos de control de la PA, añadir el tratamiento farmacológico antihipertensivo2 (E). La ESH recomienda objetivos inferiores a 140/903.
• Aquellos pacientes diabéticos con cifras de PA más elevadas (≥ 140/90 mmHg) en el diagnóstico o durante el seguimiento, deberían iniciar tratamiento farmacológico añadido a los cambios del estilo de vida2 (A).
• El tratamiento antihipertensivo en el paciente diabético basado en las diferentes clases farmacológicas como in- hibidores del enzima de conversión de la ECA (IECA), antagonistas de los receptores de la angiotensina II (ARA 2), beta bloqueantes, antagonistas del calcio (CA) o diuréticos, se han mostrado eficaces a la hora de reducir los even- tos cardiovasculares, de manera que todos pueden ser considerados válidos en el manejo del paciente diabético, ya que el beneficio se debe fundamentalmente al descenso "per se" de las cifras de PA3. Los datos publicados del estudio International VErapamil SR-Trandolapril study (INVEST)21 realizado en 6.400 diabéticos aleatorizados a un régimen basado en Verapamil SR versus Atenolol, confirma dichos resultados al no observar diferencias significa- tivas en cuanto a reducción de eventos cardiovasculares con ninguna de la estrategias farmacológicas utilizadas.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos • Si bien las evidencias sobre si los fármacos que actúan a nivel del SRA aportan beneficios adicionales sobre otras clases terapéuticas en los pacientes diabéticos son controvertidas, la ADA recomienda en base a las diversas evidencias utilizar un inhibidor del sistema renina angiotensina (SRA) como tratamiento de inicio o instaurase precozmente en los pacientes diabéticos con HTA7. En este sentido, datos recientes de los estudios ADVANCE16 (Perindopril-Indapamida) y ACCOMPLISH17 ( benazepril-amlodipino) confirman que el bloqueo del SRA es efecti- vo en la prevención de eventos micro y macrovasculares en pacientes diabéticos de alto riesgo vascular e HTA.
• En cuanto al uso de diuréticos, se recomienda el uso de diuréticos tiazídicos en los pacientes diabéticos con filtra- do glomerular (FG) ≥30 ml/min y utilizar diuréticos de asa cuando el FG < 30 ml/min2 (C).
• La mayor parte de los pacientes diabéticos con HTA requieren terapias antihipertensivas combinadas para con- seguir alcanzar el objetivo de control de las cifras de PA2 (B). Muchos de los pacientes requieren incluso 3 o más combinaciones farmacológicas19. En este sentido la guía de la ESH recomienda la utilización de un bloqueante del SRA dentro de estas combinaciones por su demostrada superioridad en la detención o enlentecimiento de la nefropatía diabética3. • En aquellos pacientes en los que se utilicen fármacos bloqueantes del SRA o diuréticos, es necesaria una monito- rización de los niveles plasmáticos de potasio (E).
• Durante el embarazo, las pacientes diabéticas con HTA crónica, se aconsejan objetivos de PA todavía más estric- tos, con cifras de PAS entre 110-129 mmHg y cifras de PAD entre 65-79 mmHg, para preservar la salud materna y minimizar las complicaciones fetales2. Durante el embarazo están totalmente contraindicados el uso de IECAS o los ARA 2 por ser teratogénicos. Al igual que la población no diabética se consideran seguras y eficaces la me- tildopa, el labetalol, el diltiazem, la clonidina y el prazosin en estas circunstancias. El uso de diuréticos durante el embarazo esta desaconsejado por restricción del volumen plasmático materno que podría inducir una hipoper- En los pacientes diabéticos las cifras de PA deben mantenerse sobre valores de PA entre 139-130/89-80 mmHg, evitando reducir las cifras de PAS < 120 mmHg.
1. Los pacientes diabéticos habitualmente requieren combinaciones de dos o más fármacos antihipertensivos para alcanzar el objetivo de control de la PA, fundamentalmente la PAS. 2. Si bien se ha demostrado que los IECAS son fármacos con acción cardioprotectora y el bloqueo del SRA ha de- mostrado ser nefroprotector, no existe ningún consenso sobre la utilización de fármacos antihipertensivos en el 3. Los beneficios del control de la PA en el paciente diabético, se deben más al descenso de las cifras de la PA "per se" que las propiedades individuales de cada clase farmacológica.
4. La utilización de fármacos que bloqueen el SRA como parte del tratamiento combinado, es necesario en una gran proporción de los pacientes diabéticos.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 1. Weycker D, Nichols GA, O´Keeffe-Rosetti M, et al. Risk-factor clustering and cardiovascular disease risk in hyper- tensive patients. Am J Hypertens.2007; 20; 599-607.
2. Executive Summary: Standards of Medical Care in Diabetes-2010. Diabetes Care 2010. 33. Supl 1:S11-S61 3. Mancia G, Laurent S, Agabiti-Rosei E, et al. Reappraisal of European Guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hypertens.2009;27:2121-2158.
4. Bobrie G, Chatellier G, Genes N, Clerson P, Vaur L, Vaisse B, Menard J, Maillon JM. Cardiovascular prognosis of "masked hypertension"detected by blood pressure self-measurement in elderly treated hypertensive patients. JAMA 2004. 291; 1342-1349.
5. Sega R, Facchetti R, Bombelli M, Cesana G, Corrao G, Grassi G, Mancia G. Prognostic value of ambulatory an d home blood pressures compared with office blood pressure in general population:follow-up results from the Presioni Arteriose Monitorate e Loro Associazioni (PAMELA study). Circulation. 2005; 111:1777-1783.
6. Cushman WC, Evans GW, Byington RP, et al from ACCORD Study group. Effects of intensive blood-pressure con- trol in type 2 diabetes mellitus. N Engl J Med 2010;362;1575-1585.
7. Cooper-DeHoff R, Gong Y, Handberg E, Bavry A, Denardo S, Bakris G, et al. Tight blood pressure control and car- diovascular Outcomes Among Hypertensive Patients with Diabetes and Coronary Artery Disease. JAMA.2010; 8. Curb JD, Pressel SL, Cutler JA, et al. Effect of diuretic-based antihypertensive treatment on cardiovascular disease in older diabetic patients with isolated systolic hypertension. JAMA.1996;276:1886-1892.
9. Staessen Ja, fagard R, Thijs L, et al. Randomise double-blind comparison of placebo and active treatment for ol- der patiens with isolated systolic hypertension. The systolic Hypertension in Europe (Sys-Eur) Trial Investigators. Lancet. 1997; 350:757-64 10. Hansson L, Zanchetti A, Carruthers SG, Dahlof B, Elmfeld D, Julius S, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension :principal results of the Hypertension Optimal Treatment (HOT) randomised trial. HOT Study Group. Lancet. 1998; 351; 1755-1762.
11. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular complications in type-2 diabetes: UKPDS 38. BMJ .1998;317:703-713.
12. Holman R, Paul S, Bethel MA, Neil A, Matthews D. Long-Term follow-up after tiht control of blood Pressure in Type 2 Diabetes. N Engl J Med. 2008;359:1-12.
13. Lindholm LH, Ibsen H, Dahlöf B, et al from LIFE study group. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet. 2002;359:1004-1010.
14. Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting-enzime inhibitor or calcium channel blocker vs. diuretic. The Antihypertensive and lipid-lowering Treatment to Prevent Heart Attack Trial (ALLHAT). The ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. JAMA 15. Mancia G, Brown M, Castaigne A, et al. INSIHT:Outcomes with nifedepine GITS or Co-amilozide in hypertensive diabetics and nondiabetics in intervention as a Goal in Hypertension (INSIGHT). Hypertension.2003; 41:431-436.
16. Patel A, Mc Mahon S, Chalmers J, Neal B, et al for ADVANCE Collaborative group. Effect of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet.2007;370:829-840 17. Weber MA, Jamerson K, Bakris GL, et al. for the ACCOMPLISH investigators. Cardiovascular events in patients with diabetes and hypertension receiving rennin angiotensin system blockade plus diuretic or a calcium chan- nel blocker. J Am Coll cardiol 2010 .
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos 18. Chaturvedi N, Porta M, Klein R, Orchard T, Fuller J, Parving HH, Bilous R, et al. DIRECT programme Study group. Effect of candesartan on prevention (DIRECT-Prevent 1) and Progresion (DIRECT-protect 19 of retinopathy in type 1 diabetes: randomised, placebo-controlled trials. Lancet.2008;372:1394-1402.
19. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al. The Seventh Report of the Joint Na- tional Committee on Prevention, Detection, Evaluation, and Treatment of High blood Pressure: the JNC report. JAMA. 2003; 289:2560-2572. 20. Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA, Harsha D et al. Effects on blood pressure of reduced dietary sodium and the Dietary Approches to Stop Hypertension (DASH) diet:the DASH-sodium Collaborative Research group. N Engl J Med.2001; 344:3-10.
21. Bakris G, Gaxiola E, Messerli F, Mancia G, Erdine S, Cooper-DeHoff R, et al. for the INVEST investigators. Clinical Outcomes in the Diabetes Cohort of the International Verapamil SR-Trandolapril study. Hypertens.2004; 44:637- Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos Múltiples estudios, epidemiológicos y ensayos clínicos, han demostrado una relación causal entre las alteraciones lipí- dicas de los pacientes con DM2 y el desarrollo de la arteriosclerosis. De todos ellos, es bien conocido que los niveles del colesterol vehiculizado por las LDL (c-LDL) es el mejor predictor de enfermedad coronaria seguido del colesterol vehicu- lizado por las HDL (c-HDL). El papel de los triglicéridos (TG) en el desarrollo de la enfermedad cardiovascular es más con- trovertido aunque en los últimos metanálisis se ha demostrado que un descenso de los TG muestra una disminución del riesgo de eventos coronarios. Por otra parte, otros estudios sugieren que la apolipoproteína B (apoB) es mejor marcador de enfermedad cardiovascular que el c-LDL y el colesterol no-HDL (c-No HDL) e incluso refleja mejor el riesgo cardiovas- cular residual en los pacientes tratados. En la DM2, las alteraciones del metabolismo lipoproteico cuya prevalencia se encuentra entre el 40 y el 60%, es decir entre 2-3 veces más frecuente que en la población no diabética, pueden preceder durante años a la aparición de hiper- glucemia y por tanto constituyen uno de los principales factores de riesgo implicados en el elevado riesgo vascular de esta población. De ahí la importancia de una buena evaluación, diagnóstico, manejo y control de la dislipemia en estos FISIOPATOLOGÍA DEL METABOLISMO LIPOPROTEICO EN LA DM TIPO 2
En la DM2, la prevalencia de hipercolesterolemia y aumento del c-LDL es parecida a la de la población general, sin embar- go, la presencia de un incremento en las cifras de TG junto a un descenso en los niveles de c-HDL es de 2 a 4 veces superior a la población general. Estas alteraciones características del metabolismo lipoproteico en los pacientes con DM-2 es lo que se ha denominado dislipemia diabética o aterogénica y se define como la combinación de un déficit de c-HDL, un exceso de TG y un aumento de la proporción de partículas LDL pequeñas y densas (tríada aterogénica). Además de ello existe un incremento del número total de otras partículas remanentes aterogénicas (VLDL e IDL) lo cual se manifiesta por un aumento de la concentración de apoB (hiperapoB) y del c-No HDL que es el colesterol total menos el c-HDL. Cuanto mayor es la concentración plasmática de TG y c-LDL y cuanto menor es la de c-HDL, mayor es el riesgo cardiovascular del paciente. En la Tabla 1 se resumen las alteraciones lipoproteicas características de los pacientes con DM2.
Tabla 1. Alteraciones lipoproteicas características en los pacientes con DM2
• c-No HDL• apoB• LDL pequeñas y densas• Lipemia postprandial El mecanismo fundamental que da lugar a las alteraciones lipoproteicas en estos pacientes es el incremento en la libera- ción de ácidos grasos libres (AGL) desde el tejido adiposo hacia el torrente circulatorio y a la existencia de un estado de insulinorresistencia. Este incremento en la producción de AGL en los pacientes diabéticos se debe fundamentalmente a 2 causas: en primer lugar, los pacientes suelen ser más obesos y por tanto tienen una mayor cantidad de tejido graso preferentemente localizado a nivel visceral y, de forma subsiguiente una mayor posibilidad de eliminar AGL desde estos depósitos; en segundo lugar, los pacientes no sólo son resistentes a la acción hipoglucemiante de la insulina, sino que también son resistentes a otras acciones de la insulina, como su acción antilipolítica. Existe una enzima denominada li- pasa hormono sensible que controla la liberación de AGL desde el tejido adiposo de tal forma que cuando aumentan las concentraciones de insulina en sangre, se reduce su actividad y se dejan de liberar AGL desde el tejido adiposo. En caso de insulinorresistencia no se produce esta inhibición y la cantidad de AGL liberados al torrente circulatorio es mayor.
Los AGL circulan en la sangre y llegan al hígado, donde van a favorecer la síntesis de TG, depositándose en el interior de la célula y dando lugar a una complicación relativamente frecuente en los pacientes diabéticos, la esteatosis hepática o hí- gado graso. El incremento hepático de TG se acompaña de un aumento de la liberación hepática de partículas VLDL. Estas partículas, ricas en TG, son las que explican la elevación en la concentración plasmática de TG observada en los pacientes diabéticos. A nivel de los tejidos periféricos, fundamentalmente tejido adiposo, corazón y músculo estriado, las VLDL son hidrolizadas por una enzima localizada en la superficie endotelial, denominada lipoproteinlipasa (LPL). Esta enzima es Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
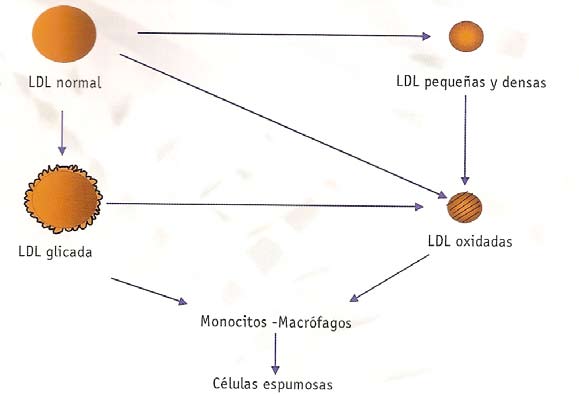
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
activada por la insulina, de tal manera que cuando existe resistencia insulínica no se degradan los TG de las partículas de
VLDL y éstas se acumulan en el plasma.
En sangre, las lipoproteínas transfieren colesterol y TG entre ellas, a través de una enzima denominada proteína transfe-
ridora de ésteres de colesterol (PTEC). En situaciones de hipertrigliceridemia cuando existe un exceso de partículas de
VLDL, esta enzima transfiere TG desde las VLDL hacia las LDL y HDL y, de forma equimolar, las partículas de HDL y LDL
ceden colesterol a la partícula de VLDL. Como consecuencia de esta transferencia, la partícula de VLDL se empobrece de
TG y se enriquece en colesterol dando lugar a una lipoproteína denominada remanente de VLDL, que es muy aterógena y
que juega un papel muy importante en el mayor riesgo cardiovascular de los pacientes diabéticos. A su vez, las partículas
de LDL y HDL se empobrecen en colesterol y se enriquecen en TG lo que las convierte en sustratos ideales para la lipasa
hepática (LH) que se encuentra en el hepatocito y que hidroliza los TG de ambas partículas de tal manera que, como con-
secuencia final, las partículas de LDL han perdido colesterol, al habérselo donado a las VLDL, y han perdido TG, al haber
sido hidrolizados por la LH, convirtiéndose en LDLs pobres en colesterol y TG y más ricas en proteínas, denominándose
LDL pequeñas y densas. Lo mismo sucede con las HDL pero, al ser éstas pequeñas y densas, se eliminan a nivel renal y
desparecen del plasma, lo cual conlleva una disminución de los niveles plasmáticos de c-HDL.
Las partículas de LDL pequeñas y densas son aterógenas por diferentes motivos: son fácilmente oxidables y, cuando se
han oxidado, son captadas por el receptor de los macrófagos, formando células espumosas. Además, las LDL de los pa-
cientes diabéticos, se glican con facilidad, lo cual facilita su oxidación y su captura por los monocitos y macrófagos en la
pared endotelial, formando células espumosas (Fig. 3)
Las alteraciones lipoproteicas en la DM2 raramente se normalizan por completo con la optimización del control glucé-
En el estudio UKPDS se evaluaron cuáles eran los factores de riesgo más importantes para el desarrollo de cardiopatía
isquémica en la población diabética: el aumento del c-LDL y el descenso del c-HDL se situaron por encima del incremento
de la presión arterial sistólica, de los niveles de hemoglobina glicosilada y del tabaquismo.
Fig 3. Aterogenicidad de las LDL en pacientes DM2.
CLÍNICA Y DIAGNÓSTICO
Las manifestaciones clínicas de la dislipemia diabética derivan en las complicaciones vasculares observadas en la diabe-
tes, constituyendo su factor patogénico fundamental. Sólo en caso de hipertrigliceridemia grave (> 2000 mg/dL) pueden
aparecer signos clínicos como lipemia retinalis, xantomas y riesgo de pancreatitis aguda.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Para establecer el diagnóstico de dislipemia diabética (aterógena) es preciso comprobar la alteración en al menos 2 oca-
siones tras un ayuno de al menos 12 a 14 horas, sin cambios de peso, siguiendo la dieta habitual durante las 3 semanas
previas, en ausencia de enfermedades intercurrentes y sin ingesta de fármacos que alteren el metabolismo lipídico. Esta-
blecido el diagnóstico de dislipemia aterogénica, el proceso de evaluación del paciente diabético debería incluir:
a. Descartar otras posibles causas secundarias de dislipemia como puede ser el alcohol, obesidad mórbida o extre-
ma, trastornos tiroideos, enfermedades hepáticas o renales, etc.
b. Establecer el fenotipo de la dislipemia (con o sin quilomicrones, hipercolesterolemia, hipertrigliceridemia o hi-
perlipemia mixta o combinada).
c. Investigar si hay historia familiar de dislipemia y de enfermedad cardiovascular precoz, especialmente en familia-
res de primer grado.
En los pacientes con diabetes se debe solicitar a nivel bioquímico un perfil lipídico que incluye la determinación de TG,
colesterol total y c-HDL. A partir de ahí nosotros podemos calcular el c-LDL por medio de la fórmula de Friedewald siem-
pre que los TG no sean superiores a 400 mg/dL.
Fórmula de Friedewald
C-LDL (mg/dL) = colesterol total (mg/dL) – [(c-HDL (mg/dL)) + (TG (mg/dL)/5)]
Cuando los TG son superiores a 200 mg/dL pierde precisión la fórmula en el cálculo del c-LDL y en caso de que los TG sean
superiores a 400 mg/dL sería incalculable el c-LDL ya que infraestimaría su verdadero valor y es necesario utilizar como
valor el c-No HDL que es igual al colesterol total (mg/dL) – c-HDL (mg/dL). Cuando la concentración de TG excede de 150
mg/dL existe un aumento de partículas de LDL pequeñas y densas. Para una mayor aproximación a este tipo de partículas
nocivas de LDL, la determinación de apoB y el cálculo del c-No HDL permitirá obtener una estimación del número de par-
tículas aterogénicas circulantes. En la actualidad existen objetivos establecidos tanto de c-LDL como de otros parámetros
lipídicos, en pacientes diabéticos con y sin enfermedad vascular por parte del panel americano de colesterol (documento
ATP-III) y de la Sociedad Americana de Diabetes, ADA 2009 (Tabla 2 y 3).
Tabla 2. Recomendaciones del panel de expertos americano ATP III.
Siempre se deben añadir estatinas
Enfermedad vascular
c-LDL < 70 mg/dL
Si TG > 200 mg/dL = c-No HDL independientemente de la
concentración de c-LDL
Siempre se deben añadir estatinas
c-LDL < 100 mg/dL
Si TG > 200 mg/dL = c-No HDL independientemente de la
concentración de c-LDL
A todo paciente se le debe recomendar una dieta baja en grasas saturadas, ácidos grasos trans y colesterol, el conseguir un peso
cercano al ideal y ejercicio físico diario
Tabla 3. Recomendaciones ADA 2009.
Objetivo 2º. Si no se alcanzan los 1º con
dosis altas de estatinas o si c.-LDL poco por
encima de 100 mg/dL
Enfermedad vascular
c-LDL < 70 mg/dL
independientemente de la
concentración de c-LDL *
c-LDL < 100 mg/dL
independientemente de la
1 factor de riesgo
concentración de c-LDL *
c-LDL < 100 mg/dL
* Se pueden añadir otros hipolipemiantes si no se alcanzan objetivos y c-LDL < 30-40%
A todo paciente se le debe recomendar una dieta baja en grasas saturadas, ácidos grasos trans y colesterol, el conseguir un peso
cercano al ideal y ejercicio físico diario. El mejor control glucémico mejora el perfil lipídico.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Una alternativa que cada vez se está empleando más es el conocer los valores de apoB que nos informan mejor del
número de partículas aterógenas. De esta forma la Sociedad Canadiense de Cardiología, la American Heart Association
y más recientemente la American Diabetes Association y el American College of Cardiology incluyen a la apoB entre
sus objetivos. El nivel de apoB equivalente para una concentración de c-LDL < 100 mg/dL estaría en torno a < 0.9 g/L.
En pacientes de riesgo muy alto, los niveles de apoB aconsejados serían inferiores a 0.8 g/L. El problema es que esta
medición no se realiza por muchos laboratorios actualmente.
TRATAMIENTO
1. Objetivos terapéuticos
Dos posibles estrategias desde el punto de vista terapéutico son necesarias aplicar en el manejo del paciente diabético
con dislipemia aterógena y serían la reducción en los niveles de c-No HDL a < 130 mg/dL y c-LDL < 100 mg/dL (o en caso
de que se asocie enfermedad cardiovascular < 70 mg/dL que corresponde a un c-No HDL < 100 mg/dL) como se indica
en la Tabla 2 y 3 y por otro lado es necesario una corrección de otras alteraciones lipídicas (fundamentalmente reducir
los niveles de TG y aumentar el c-HDL). Existe un amplio consenso de que lo prioritario para reducir eventos cardiovas-
culares en los pacientes con diabetes es la reducción del c-LDL por dos motivos fundamentales y es que los niveles de
c-LDL se relacionan con el desarrollo de la arteriosclerosis y por otro lado que su reducción conlleva una disminución
de la enfermedad coronaria e ictus.
El estudio CARDS demostró que en pacientes con DM2 la administración de 10 mg de atorvastatina redujo en un 37%
la incidencia de síndrome coronario agudo fatal o no fatal, la revascularización o ictus. La ATP III recomienda que en
todo paciente con DM2 y enfermedad cardiovascular se reduzca el c-LDL por debajo de 70 mg/dL de acuerdo con los
resultados del estudio TNT y otros y por debajo de 100 mg/dL en aquellos que no tengan enfermedad cardiovascular.
Esto ha sido corroborado por la ADA 2009 (Tabla 2 y 3).
Se recomienda el uso de estatinas como tratamiento de elección. Como objetivo secundario lo que se plantea es con-
seguir al menos unas reducciones de c-LDL entre un 30-40% con estatinas en pacientes con DM2 con enfermedad
vascular o > de 40 años, aunque no alcancemos los objetivos (Tabla 3).
En el ATP III se establece que los valores de TG deseables en DM2 han de ser < 150 mg/dL. Entre 150 y 200 mg/dL se
consideran valores bordeline e hipertrigliceridemia a partir de 200 mg/dL y en estos casos habrá que valorar no sólo
los valores de c-LDL sino que también de c-No HDL y que estén dentro de los objetivos terapéuticos. Niveles de TG por
encima de 500 mg/dL son de carácter severo y es preciso tratamiento para prevenir la aparición de pancreatitis. Sin
embargo en las recomendaciones del Foro HDL y de la ADA 2009, la concentración reducida de c-HDL (< 40 mg/dL en
varones y < 50 mg/dL en mujeres) y las concentraciones de TG > 200 mg/dL, son una diana terapéutica, debiendo ser
el objetivo ≤ 150 mg/dL.
2 Medidas terapéuticas
* Cambios en los estilos de vida
Indudablemente antes de iniciar un tratamiento farmacológico de por vida se debe intentar recomendar cambios en
los estilos de vida hacia una vida más cardiosaludable a todos los pacientes diabéticos (dejar de fumar, hacer deporte,
disminuir el peso, etc) sobre todo haciendo más hincapié en aquellos pacientes con niveles plasmáticos de c-LDL > 100
mg/dL. Estos cambios del estilo de vida han de plantearse a largo plazo y por tanto hay que estructurar toda la actividad
del paciente (comidas, deporte, hábitos, etc). Con ello se disminuye el número de pacientes que van a precisar de trata-
miento farmacológico o se van a poder conseguir los objetivos terapéuticos marcados con dosis más bajas de fármacos
y de esta forma disminuiremos la posibilidad de efectos adversos.
La dieta es el principal factor exógeno que influye sobre la concentración lipoproteíca de tal forma que tanto el exceso
de grasa saturada como de colesterol dietético así como el incremento del número de calorías conllevan a un empeo-
ramiento del perfil lipídico del paciente. El otro factor exógeno que modifica de forma directa los niveles de TG es el
alcohol al inhibir parcialmente a la enzima LPL. La Sociedad Española de Arteriosclerosis tiene una tabla de alimentos
que los clasifica en recomendables, a limitar (2-3 veces por semana) y desaconsejables en función de su conveniencia
en el caso de dislipemia. Como norma general se debe consumir entre el 30-35% de la energía de la dieta en forma de
grasa y de ella 8-10% debe ser saturada, 7-10% poliinsaturada y el resto monoinsaturada salvo que exista una hiper-
trigliceridemia > 1000 mg/dL en cuyo caso se debe restringir el consumo de grasa total a < 10% de las kcal ingeridas.
La ingesta diaria de colesterol dietético debe ser < 300 mg/día. El alcohol debe suprimirse completamente en caso
de aumento de TG. El aporte energético total debe reducirse si existe sobrepeso u obesidad. La reducción de TG y el
incremento del c-HDL así como el aumento del tamaño de las partículas LDL parecen depender más de la pérdida de
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
peso y la disminución de la concentración de c-LDL de la reducción de grasa saturada de la dieta. Todo ello supondrá
una mayor presencia en la dieta de frutas, verduras, legumbres, productos lácteos desnatados, aceite de oliva virgen,
pescados y carnes blancas.
En cuanto a las hipertrigliceridemias, la mayoría de los autores apuestan en primer lugar por una serie de medidas higié-
nico-dietéticas y cambios en los estilos de vida cuando los TG son superiores a 400 mg/dL antes de iniciar tratamiento
farmacológico con fibratos, ácido nicotínico y/o ácidos grasos omega-3.
En el caso de obesidad abdominal determinada por un perímetro de cintura > de 88 cm en mujeres y > de 102 cm en
los hombres hay que incrementar el gasto energético con una mayor actividad física y disminuir el aporte calórico. La
actividad física debe ser aeróbica y de intensidad moderada a intensa (caminar, correr, footing, bicicleta, nadar, etc), al
menos 30 minutos al día y progresar hasta 60 minutos al día todos los días de la semana (caminar 30 minutos diarios
equivale a un gasto calórico de aproximadamente 2000 kcal/semana y de 28 Km./semana) así como en cuanto a la in-
gesta calórica debe ser la adecuada para alcanzar y mantener un peso ideal o aceptable por lo que se deben reducir las
calorías entre 500-1000 calorías al día que conlleva pérdidas de peso entre 0.5 y 1 Kg. a la semana. El objetivo es alcanzar
una pérdida de peso de al menos un 5-10% de su peso corporal en los próximos 3-6 meses y aproximarse a un IMC de
El ejercicio físico influye favorablemente sobre el metabolismo lipoproteico ya que eleva el c-HDL entre 2 y 8 mg/dL y
desciende los TG entre 5 y 38 mg/dL, de ahí su importancia.
El cese del tabaquismo conlleva efectos beneficiosos al reducir el riesgo cardiovascular (además de procesos oncológi-
cos) y mejora el perfil lipídico, sobre todo el más eficaz es el incremento en los niveles de c-HDL.
* Control glucémico.
La optimización del control glucémico en el paciente diabético independientemente de las medidas terapéuticas utili-
zadas, puede reducir las cifras de TG y c-LDL e incrementar los niveles de c-HDL y el tamaño de las partículas de LDL ya
que se produce un descenso del flujo de AGL y la producción hepática de VLDL. Además algunos fármacos hipogluce-
miantes que actúan sobre la resistencia insulínica y favorece el control de la glucemia como ocurre con la metformina,
glitazonas (sobre todo la pioglitazona) y los inhibidores de la DPP-4 (sitagliptina y vildagliptina) modulan los niveles
plasmáticos de lípidos en estos pacientes en sentido antiaterogénico. Es conocido, de diferentes ensayos clínicos, como
la metformina parece disminuir el c-LDL y las glitazonas aumentan el c-HDL y el tamaño de las LDL. A igualdad de efecto
sobre el control glucémico, la pioglitazona frente a la rosiglitazona es más eficaz en descender los TG (- 40 versus -1.1
mg/dL) y en aumentar el c-HDL (+ 4.6 versus 2.7 mg/dL) así como en la modificación de la concentración y del tamaño
de las partículas de LDL.
* Tratamiento farmacológico hipolipemiante.
Este tratamiento debe ir asociado a las medidas higiénico-dietéticas anteriormente referidas y debe iniciarse tras 6-12
semanas de tratamiento dietético y cambios del estilo de vida, cuando no se consigan el objetivo esperado de c-LDL <
100 mg/dL y/o c-No HDL < 130 mg/dL. En los pacientes con un riesgo cardiovascular elevado y dislipemia importante
pueden iniciarse simultáneamente con las medidas higiénico-dietéticas.
Primer objetivo del tratamiento farmacológico: disminuir el c-LDL y c-No HDL. Los fármacos de 1ª elección serían las es-
tatinas. Ezetimiba y ácido nicotínico en monoterapia serían la 2ª elección. Los fibratos disminuyen de forma variable el
colesterol total y el c-LDL, y aumentan el c-HDL; por ello, son una alternativa adicional para disminuir el c-No HDL. Las
resinas pueden utilizarse para disminuir el c-No HDL y el c-LDL pero incrementan los niveles de TG por lo que no debe
emplearse en pacientes con hipertrigliceridemia. Los esteroles vegetales inducen disminuciones moderadas del c-LDL
y del c-HDL que son de menor magnitud que las que producen la ezetimiba y las resinas.
Segundo objetivo en el tratamiento: normalizar la concentración de TG cuando no lo han conseguido los cambios en el
estilo de vida o tras la administración de estatinas ya que producen un descenso leve de TG. En el caso de que los TG
superen los 500 mg/dL (hipertrigliceridemia severa) se planteará como primer objetivo el descenso de TG y en aquellos
casos en que exista una hipertrigliceridemia moderada (200-500 mg/dL) se limitará el uso de fármacos en los casos en
que el paciente sea de alto riesgo vascular. El objetivo es alcanzar un valor de TG < de 150 mg/dL. Los fármacos de mayor
eficacia para disminuir los TG son los fibratos, seguidos de los ácidos omega-3 y el ácido nicotínico.
El tratamiento farmacológico del déficit de c-HDL se planteará también en aquellos pacientes con un riesgo vascular
elevado así como el exceso de TG, es un segundo objetivo después de normalizar el c-LDL y c-No HDL. El fármaco más
eficaz disponible para incrementar los niveles de c-HDL es el ácido nicotínico y en segundo lugar, los fibratos, seguido
de algunas estatinas, sobre todo rosuvastatina (Tabla 4).
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Tabla 4. Principales fármacos hipolipemiantes para tratar la dislipemia diabética
A. Disminución del c-LDL y c-No HDL (a)
* 1ª elección: estatinas.
* 2ª elección: ezetimiba, ácido nicotínico.
* 3ª elección: resinas (evitar si TG están ), fibratos, esteroles vegetales
B. Disminución de TG, lipoproteínas ricas en TG (VLDL) y la lipemia postprandial
* 1ª elección: fibratos
* 2ª elección: ácido nicotínico o ácidos grasos omega-3
* 3ª elección: estatinas
C. Aumento del c-HDL
* 1ª elección: ácido nicotínico
* 2ª elección: fibratos
* 3ª elección: estatinas
a. Si los TG son > 400 mg/dL, no puede calcularse c-LDL y el objetivo ha de ser el c-No HDL.
Existen en el mercado 6 estatinas que están comercializadas y las de mayor potencia son capaces de disminuir el c-LDL
hasta un 50% o más a dosis elevadas (Tabla 5).
Tabla 5. Efecto de las estatinas sobre las concentraciones séricas de c-LDL y su relación con la dosis
Disminución de c-LDL y de c-No HDL (%)
Rosuvastatina, atorvastatina y simvastatina, son las de mayor potencia hipocolesterolemiante. Por ello antes de elegir el
tipo de estatina y la dosis debemos conocer que porcentaje de reducción de c-LDL es necesario para alcanzar el objetivo
terapéutico. Para ello el Dr. Masana publicó de manera gráfica y a color la opción terapéutica para reducir el c-LDL en
función del basal y objetivo final (Fig. 4).
En pacientes que requieren de descensos del c-LDL y/o c-No HDL superiores al 50% suelen ser necesarios asociar estati-
nas a ezetimiba (Tabla 6) o utilizar estatinas de gran potencia como atorvastatina o rosuvastatina a la dosis máxima para
conseguir objetivo terapéutico (Tabla 5). Una segunda opción es asociar estatinas con ácido nicotínico o con fibratos que
tiene la ventaja de aumentar c-HDL y descender TG de forma más acusada por lo que disminuirá el c-No HDL. Siempre
que se asocie estatinas con fibratos para alcanzar un control global y más eficaz de las alteraciones del metabolismo
lipídico del paciente con dislipemia aterogénica evitar administrar gemfibrozilo por el riesgo de hepatopatía y miopatía.
También debemos prestar atención a las interacciones farmacológicas. Se debe monitorizar los niveles de creatinfosfo-
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
quinasa (CPK) y transaminasas y en caso de mialgias (niveles de CPK normal) o valores alterados de transaminasas (incre-
mento de 3 veces el valor normal) y/o CPK (incremento de 10 veces el valor normal) que en este caso sería una miositis
deberá interrumpirse el tratamiento y solicitar consulta médica.
Tabla 6. Principales combinaciones de fármacos hipolipemiantes para tratar la dislipemia diabética
A. Disminución del c-LDL y c-No HDL (a)
* 1ª elección: estatinas + ezetimiba.
* 2ª elección: estatinas + ácido nicotínico, estatinas + fibratos.
* 3ª elección: fenofibrato + ezetimiba, estatinas + resinas (evitar si TG están ), estatinas + esteroles vegetales
B. Disminución de TG
* 1ª elección: fibratos + ácidos grasos omega-3, fibratos + ácido nicotínico
* 2ª elección: ácido nicotínico + ácidos grasos omega-3
* 3ª elección: estatinas + fibratos, ácidos grasos omega-3 ó ácido nicotínico
C. Aumento del c-HDL
* 1ª elección: ácido nicotínico + fibratos
a. Si los TG son > 400 mg/dL, no puede calcularse c-LDL y el objetivo ha de ser el c-No HDL.
La combinación de estatinas y ácido nicotínico es eficaz en el descenso del c-LDL y TG además de incrementar el c-HDL,
induce regresión de la aterosclerosis y previene la enfermedad coronaria. La combinación de fibratos y resinas y de es-
tatinas con ácidos grasos omega-3, son alternativas para los pacientes con dislipemia mixta e intolerantes a otras com-
binaciones. En aquellos pacientes con hipertrigliceridemia que no puede ser controlada con fibratos se puede asociar
ácido nicotínico o ácidos grasos omega-3 para potenciar el efecto hipotrigliceridemiante. Puede asociarse fenofibrato
y ezetimiba o estatinas y resinas, ya que estas últimas potencian el efecto de las estatinas sobre el c-LDL. Por último, los
esteroles vegetales potencian el efecto de las estatinas, aunque en menor medida que los otros fármacos inhibidores de
la absorción de colesterol, es decir ezetimiba y las resinas. En el hipotético caso de que no se consiga normalizar el c-No
HDL o c-LDL asociando 2 fármacos se puede recurrir a la triple terapia con estatinas, ezetimiba y ácido nicotínico o bien
estatinas, ezetimiba y fibratos, con las precauciones anteriormente referidas. En aquellos pacientes que tienen niveles de
TG y c-HDL dentro de la normalidad pero que presentan un exceso de c-LDL se podría usar la triple terapia con estatinas,
ezetimiba y resinas.
Para disminuir los TG, la combinación de fibratos con ácidos grasos omega-3 o de fibratos con ácido nicotínico es muy
eficaz. También se puede emplear la combinación de ácido nicotínico y ácidos grasos omega-3. En los pacientes con
hipertrigliceridemia que no se controlan con 2 fármacos se puede recurrir a la triple terapia con fibratos, ácido nicotínico
y ácidos grasos omega-3.
En los pacientes con descenso del c-HDL que no se incrementa al usar monoterapia para descender los niveles de c-LDL,
puede utilizarse la asociación de fibratos con ácido nicotínico. Actualmente está en desarrollo nuevos fármacos que
incrementan los niveles de c-HDL entre los que se encuentran los inhibidores de la proteína transferidora de ésteres de
colesterol (PTEC), péptidos miméticos de la apoA1 y fármacos activadores de la transcripción nuclear para la apoA1.
En resumen, paciente diabético con dislipemia diabética estará indicado iniciar el tratamiento con una estatina de gran
potencia y a dosis adecuada para alcanzar los objetivos de c-LDL y/o c-No HDL. Si tras ello no se logran los objetivos de
c-LDL o c-No HDL y/o persisten los TG elevados y además un descenso del c-HDL estará indicado asociar un segundo
fármaco que puede ser ezetimiba (efecto hipocolesterolemiante) o fibrato, ácido nicotínico o ácidos grasos omega-3
(efecto hipotrigliceridemiante).
3 Principales características de los diferentes grupos farmacológicos para el control de la dislipemia diabética:
a. Estatinas. Inhibidores de la enzima 3-hidroxi-3-metilglutaril coenzima A reductasa (HMG-CoA reductasa) o es-
tatinas, disminuyen la producción endógena de colesterol (que es la más abundante) y provocan depleción del
colesterol intracelular desencadenando una mayor actividad y expresión de los receptores celulares de las LDL y
por ende un mayor aclaramiento plasmático de las lipoproteínas LDL, IDL y VLDL. Además, las estatinas disminu-
yen la secreción hepática de VLDL. Las más potentes son capaces de disminuir el c-LDL hasta más de un 50% a
dosis elevadas (Tabla 5). Además incrementan el c-HDL entre un 5-15% y los TG lo disminuyen de forma variable,
en general entre 10-40%. La administración de las estatinas debe ser por la noche excepto atorvastatina y rosu-
vastatina que tiene una vida media muy larga (entre 14 y 19 horas, respectivamente) por lo que se pueden dar a
cualquier hora del día. En cuanto a las interacciones y los efectos secundarios, las estatinas que se metabolizan
por la isoenzima 3A4 del citocromo P450 (lovastatina, simvastatina y atorvastatina) presentan más interacciones
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
al existir un mayor número de fármacos que inhiben o utilizan esta ruta metabólica. Entre ellos antifúngicos,
macrólidos, ciclosporina y bloqueantes de los canales del calcio. La pravastatina se metaboliza a través de vías
independientes de la citocromo P450 y la rosuvastatina sólo en un 10%. No se debe asociar ninguna de las esta-
tinas con gemfibrozilo (está contraindicada) y se recomienda evitar dosis máximas de estatinas cuando se asocia
con bezafibrato o fenofibrato. Son fármacos bien tolerados y el porcentaje de efectos adversos que obliguen a
interrumpir su tratamiento es escaso. Sólo puede producir incremento moderado de transaminasas (1-2% de
pacientes) a dosis máxima, la miopatía es su segundo efecto secundario más importante en forma de mialgias y
debilidad muscular, en ocasiones sin aumento de las enzimas musculares, que pueden persistir largo tiempo si se
mantiene el tratamiento. La presencia de una miopatía grave en forma de rabdomiolisis es rara y prácticamente
se limita a los pacientes con factores predisponentes, entre ellos insuficiencia hepática o renal, trasplantados,
anciano frágil y las interacciones farmacológicas. Están contraindicadas durante el embarazo y la lactancia.
b. Fibratos. Actualmente disponemos del bezafibrato, fenofibrato y gemfibrozilo. Activan a los receptores PPARalfa
(peroxisome proliferator-activating receptor alfa) que modulan la transcripción de distintos genes e inducen una
disminución de la síntesis de VLDL y un aumento del aclaramiento de dichas lipoproteínas (ricas en TG). También
activan el transporte reverso de colesterol y aumentan el c-HDL. Su efecto es distinto en función del perfil lipídico
del paciente ya que en los pacientes con hipercolesterolemia pura, los fibratos reducen el c-LDL hasta un 20%
con modificaciones inferiores en los niveles de TG y c-HDL. Sin embargo, en los pacientes con hiperlipemia mixta
ocurre lo contrario; es decir, los fibratos reducen sobre todo la concentración de TG (hasta un 50%), aumentan de
forma discreta el c-HDL (15%) y apenas modifica el c-LDL. Los fibratos están indicados en caso de hipertrigliceri-
demia asociada o no a hipercolesterolemia y en la dislipemia aterógena. La dosis diaria de fenofibrato es de 145
mg, la de bezafibrato de 400 mg y la de gemfibrozilo de 900 mg, en los 3 casos en una sola toma diaria. En caso
de hipertrigliceridemias graves se pueden administrar dosis algo superiores, en 2 a 3 tomas al día. Son fármacos
seguros y bien tolerados. Se ha descrito incrementos leves y transitorios de las transaminasas y miositis con ele-
vación de la CPK que se ve favorecido en el caso de que el paciente presente insuficiencia renal y la administra-
ción concomitante de estatinas. Los fibratos favorecen la litogenicidad de la bilis y, por tanto, es preferible evitar
su utilización en los pacientes con colelitiasis. Potencia la acción de anticoagulantes orales, no administrarse
durante el embarazo ni en la lactancia y su dosis hay que disminuirla en caso de insuficiencia renal.
c. Ezetimiba. Es una azetidiona que actúa sobre la proteína de Niemman-Pick C1 like 1 a nivel del borde en cepillo
de las células de la mucosa del intestino delgado. Disminuye la absorción de colesterol de los alimentos y del
contenido en la bilis pero no interfiere en la absorción de otros compuestos lipídicos. Se metaboliza a través de
distintas UDP-glucuroniltransferasa hepáticas e intestinales y no depende de la citocromo P450 por lo que no in-
teractúa con estatinas, digoxina, cumarínicos o anticonceptivos. La dosis diaria es de 10 mg y disminuye el c-LDL
en un 15-20%, los TG en un 10-15% y tiene efecto escaso sobre el c-HDL. Si se asocia a una estatina disminuye el
c-LDL en un 20-25% adicional. Fármaco de primera elección en caso de asociación para potenciar el efecto de
las estatinas en pacientes que no alcancen objetivos terapéuticos. Contraindicada en el embarazo y durante la
lactancia, insuficiencia hepática grave y si el paciente tiene insuficiencia renal grave (aclaramiento de creatinina
< 30 ml/min/1.73 m2) disminuir la dosis. Es bien tolerado y con pocos efectos secundarios. Si se asocia a estatinas
existe una incidencia algo mayor de hipertransaminasemia. Se puede combinar con fenofibrato en los pacientes
con dislipemia aterógena ya que potencia el efecto de descenso de c-LDL y TG que alcanza el fenofibrato.
d. Resinas de intercambio iónico. Existen 2: resincolestiramina y colestipol. Se unen a los ácidos biliares del in-
testino delgado y aumentan su excreción fecal y por ello se produce un incremento hepático de ácidos biliares
a partir del colesterol con disminución de la actividad PPAR alfa. Esta última acción va a ser la responsable del
incremento moderado de TG observado con estos fármacos (10%). Por tanto, las resinas producen depleción de
la reserva hepática de colesterol y a su vez incremento en la actividad de los receptores hepáticos de las LDL y
una mayor captación de estas lipoproteínas. Las resinas disminuyen el c-LDL en un 20-25% y son eficaces en la
prevención primaria de la enfermedad cardiovascular del paciente hipercolesterolemico. Su principal indicación
es en asociación a estatinas ya que incrementan el descenso de c-LDL en un 20%. Estos fármacos hay que darlos
1 hora antes de las comidas o de la administración de otro fármaco o 4 horas después ya que pueden interferir la
absorción intestinal de otros fármacos. Contraindicados en el embarazo y tienen múltiples efectos secundarios
fundamentalmente a nivel digestivo, sobre todo estreñimiento e intolerancia. Por ello es necesario empezar con
1 sobre al día de 4 g de resincolestiramina que equivale a 5 g de colestipol e ir aumentado la dosis en función de
la tolerancia del paciente hasta conseguir objetivos. Se ha comunicado casos aislados de una menor absorción
de vitaminas en niños (sobre todo las liposolubles) y es necesario coadministrar suplementos de folato.
e. Ácido nicotínico. Este fármaco por su efecto antilipolítico sobre el tejido adiposo, inhibe la lipólisis periférica re-
duciendo la llegada de AGL al hígado y la subsiguiente formación de TG. Sin embargo, su efecto principal parece
que se produce en el hígado al reducir la síntesis de partículas de VLDL. Al ser las VLDL precursoras de las LDL,
va a disminuir el c-LDL (10-25%) y el colesterol total. Además aumenta la síntesis de HDL y disminuye su aclara-
miento plasmático con lo cual incrementa los niveles de c-HDL en pacientes con hipertrigliceridemia de hasta
un 30%. También disminuye los TG (20-50%). La combinación de ácido nicotínico y resincolestiramina aumenta
notablemente su eficacia de reducir los niveles de c-LDL. Existen estudios que demuestra la eficacia del ácido ni-
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
cotínico sobre la prevención cardiovascular en pacientes con infarto agudo de miocardio y en la evolución de la
aterosclerosis coronaria. Está indicado en los pacientes con hipercolesterolemia o en la dislipemia mixta así como
en la hipertrigliceridemia, en general asociado a otros agentes hipolipemiantes. La dosis de ácido nicotínico es
de 2 g al día. Entre sus efectos secundarios destaca la aparición de sofocos y prurito debido a una vasodilatación
inducida por prostanglandinas. Actualmente se ha comercializado la asociación de ácido nicotínico de acción
retardada con laropripant que es un inhibidor de las prostanglandinas D2 y disminuye de forma muy acusada la
aparición de esos efectos secundarios También el ácido nicotínico puede producir aumentos moderados de los
niveles de ácido úrico y glucosa cuando se emplea a dosis elevadas. Las elevaciones medias de la glucemia son
de 4 mg/dL y en general se corrigen modificando la dosis del tratamiento hipoglucemiante. En cualquier caso los
beneficios del fármaco, en términos de reducción de eventos y de mejoría global del perfil lipídico, superan sus
f. Esteroles vegetales. Son unas moléculas que estructuralmente se asemejan al colesterol. Desde hace 20 años
se han empleado en el enriquecimiento de algunos alimentos funcionales con el objetivo de reducir la absorción
intestinal de colesterol por desplazamiento. Diversos estudios demuestran como la ingesta de 1,5 a 3 g de fitos-
teroles pueden reducir los niveles de c-LDL entre un 8-13% sin modificar TG y c-HDL. Al combinarlos con una die-
ta baja en grasas saturadas y colesterol, el descenso puede llegar al 20%. Estos alimentos pueden utilizarse para
potenciar los efectos de estatinas o fibratos. Si se asocian a un tratamiento con estatinas, su efecto es superior
al obtenido cuando se dobla la dosis de estatina. Los fitosteroles están contraindicados en una rara enfermedad
denominada sitosterolemia familiar ya que incrementaría los niveles de colesterol total en estos pacientes. Final-
mente, los esteroles vegetales pueden disminuir la absorción de vitaminas, en particular carotenos y tocoferoles,
lo que puede evitarse aumentando en una ración diaria el consumo de vegetales ricos en dichas vitaminas.
g. Ácidos grasos omega-3. El ácido eicosapentaenoico y el docosa hexaenoico a dosis de 2 a 4 gramos al día dismi-
nuyen los niveles plasmáticos de TG (25-50%) y tienen efecto escaso sobre el c-LDL y colesterol total. Sus efectos
sobre el c-HDL suele ser escaso aunque se observa incrementos moderados. La disminución de la agregabilidad
plaquetaria y su acción antiarrítmica son otros efectos destacables de estos fármacos a la dosis de 1 gr al día.
Tienen un efecto preventivo frente a la enfermedad cardiovascular.
Diagrama del tratamiento farmacológico hipolipemiante
1. En pacientes de muy alto riesgo, el objetivo sería c-LDL < 70 mg/dL, c-No HDL < 100 mg/dL y apoB < 0.8 g/L.
2. Seleccionar un fibrato si la alteración más importante es la hipertrigliceridemia, o ácido nicotínico si la alteración pre-
dominante es el c-HDL bajo.
3. Considerar glitazonas.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
• El tratamiento de la DM2 debe ser multifactorial y enérgico si queremos disminuir drásticamente el elevado ries-
go cardiovascular inherente a la diabetes, no basta conseguir unos niveles óptimos de glucemia, sino que hay que
conseguir igualmente unos niveles adecuados de presión arterial, lípidos y un estilo de vida más saludable (sin
tabaco, exceso de alcohol y realizando ejercicio físico regularmente para eliminar el sobrepeso u obesidad).
• El objetivo principal del tratamiento de la dislipemia diabética es disminuir el c-LDL a < 100 mg/dL y el c- No HDL
a < 130 mg/dL. Si está asociado una enfermedad cardiovascular los objetivos serán de 70 y 100 mg/dL, respecti-
vamente. Los objetivos secundarios son TG, c-HDL, y apoB.
• La eficacia de las estatinas en la disminución del c-LDL y c-No HDL así como las evidencias clínicas de su beneficio
hacen que sean los fármacos de primera elección en los pacientes diabéticos con dislipemia. En los pacientes
que no se alcanzan los objetivos de c-LDL o c-No HDL con dosis altas o máximas toleradas de estatinas se puede
añadir ezetimiba o una resina de intercambio iónico.
• En caso de pacientes con niveles óptimos de c-LDL pero con TG elevados y/o c-HDL disminuido, el fármaco de
elección sería el fibrato y/o ácido nicotínico.
• En los pacientes en los que exista una dislipemia diabética con incremento de los niveles de c-LDL y TG junto a
un descenso del c-HDL se tendrá que emplear o bien una estatina que modifique el perfil aterogénico y en este
sentido la más efectiva sería rosuvastatina (es la más potente en descender c-LDL y TG e incrementar c-HDL de
todas las estatinas) o lo que es más frecuente el empleo de una asociación de estatinas para reducir los niveles de
c-LDL y un fibrato o ácido nicotínico para corregir la hipertrigliceridemia e incrementar los niveles de c-HDL.
• Siempre que utilicemos estatinas y fibratos en asociación evitar prescribir gemfibrozilo ya que por las propieda-
des farmacocinéticas produce un incremento de los niveles plasmáticos de estatinas y ello condiciona la apari-
ción frecuente de mialgias, miositis y daño hepático secundario.
• Si el paciente solo presenta un marcado descenso del c-HDL se debe cambiar los hábitos de vida y no está claro
si usar un fármaco. La mayoría de autores postulan que ante un paciente de alto riesgo vascular con DM2 se
debe usar ácido nicotínico más laropripant ya que es el más eficaz para aumentar el c-HDL y como alternativa los
• Rosuvastatina, atorvastatina y simvastatina son las estatinas más potentes para disminuir c-No HDL y c-LDL y me-
jorar los índices aterogénicos en pacientes diabéticos con dislipemia. Ezetimiba y resinas potencian dicho efecto.
Fibratos, ácido nicotínico y ácidos grasos omega-3 disminuyen los TG; los dos primeros aumentan el c-HDL.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
1. Turner RC, Millns H, Neill HAW, Stratton IM, Matthews DR, Holman RR for the United Kingdom Prospective Diabe-
tes Study Group. Risk factors for coronary arteriy disease in non-insulin dependent diabetes mellitus: United
Kingdom Prospective Diabetes Study (UKPDS: 23). BMJ 1998;316:823-8
2. Brunzell JD, Davidson M, Furberg CD, Goldberg RB, Howard BV, Stein JH, et al. American Diabetes Association;
American College of Cardiology Foundation. Lipoprotein Management in patients with cardiometabolic risk:
consensos statement from the American Diabetes Association and the American College of Cardiology Foun-
dation. Diabetes Care 2008;31:811-22.
3. American Diabetes Association. Standards of medical care in diabetes. Diabtes Care 2009;32(suppl 1):13_S61.
4. Ascaso J, González.-Santos P, Hernández-Mijares A, et al. Management of dyslipidemia in the Metabolic Syn-
drome. Recommendations of the Spanish HDL-Forum. Am J Cardiovasc Drugs 2007;7:39-58
5. Ballantyne CM, Bertolanmi M, Hernandez García HR, et al. Achieving LDL cholesterol, non-HDL cholesterol,
and apolipoprotein B target levels in high-risk patients: Measuring Effective Reductions in Cholesterol Using
Rosuvastatin therapY (MERCURY) II. Am Heart J 2006;151:975-83.
6. Ballantyne CM, Raichlen JS, Cain VA. Statin therapy alters the relantionship between apolipoprotein B and
low-density lipoprotein cholesterol and non-high-density liipoprotein cholesterol targets in high-risk pa-
tients : The MERCURY II (Measuring Effective Reductions in Cholesterol Using Rosuvastatin) trial. J Am Coll
7. Wägner AM, Pérez A, Calvo F, Bonet R, Castellví A, Ordoñez J. Apolipoprotein B identifies dyslipidemic phe-
notypes associated with cardiovascular risk in normocholesterolemic type 2 diabetic patients. Diabetes Care
1999;22: 812-17.
8. Wägner AM, Sánchez-Quesada JL, Pérez A, Rigla M, Blanco-Vaca F, Ordóñez-Llanos J. Inaccuracy of calculated
LDL cholesterol in type 2 diabetes: consequences for patient risk classification and therapeutic decision. Clini-
cal Chemistry 2000; 46:1830-32.
9. Pérez A, Wagner AM. Dislipemia diabética: nuevas evidencias para un correcto enfoque diagnóstico. Av Dia-
10. Jiang R, Schultze MB, Li T, Rifai N, Stampfer MJ, Rimm EB, Hu FB. Non-HDL cholesterol and apolipoprotein B
predict cardiovascular disease events among men with type 2 diabetes. Diabetes Care 2004;27:1991-7.
11. Caixás A; Ordoñez-Llanos J, de Leiva A, Payés A, Homs R, Pérez A. Optimization of glycemic control by insulin
therapy decreases the proportion of small dense LDL particles in diabetic patients. Diabetes 1997; 46:1207-
12. Grundy SM, Cleeman JL, Bairey CN, Brewer HB, Clark LT, Hunninghake DB et al National Heart, Lung, and Blood
Institute; American College of Cardiology Foundation; American Heart Association. Implications of recent
clinical trials for the National Cholesterol Education Program Adult Treatmnet Panel III guidelines. Circulation
13. Kearney PM, Blackwell L, Collins R, Keech A, Simes J, Peto R, et al. Efficacy of cholesterol-lowering therapy in
18,686 peopel with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008;37:117-25.
14. Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, Bingham S, et al. Triglycerides and the Risk of
Coronary Heart Disease: 10 158 Incident Cases Among 262 525 Participants in 29 Western Prospective Stu-
dies. Circulation 2007;115:450-8.
15. Shepherd J, Barter P, Carmena R, Deedwania P, Fruchart JC, Haffner S, et al. Effect of lowering LDL cholesterol
substantially below currently recommended levels in patients with coronary heart disease and diabetes: the
Treating to New Targets (TNT) study. Diabetes Care 2006;29:1220-6.
16. Sniderman AD, Furberg CD, Keech A, Roeters van Lennep JE, Frohlich J, Jungner I, Walldius G. Apolipoproteins
versus lipids as indices of coronary risk and as targets for statin treatment. Lancet 2003;361:777-80
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
17. Wägner AM, Ordónez-Llanos J, Caixás A, Bonet R, de Leiva A, Pérez. A Quantitative effect of glycaemic impro-
vement on the components of diabetic dyslipidaemia: a longitudinal study. Diabetes Res Clin Pract 2005;68:81-3
18. Wulffele MG, Kooy A, de Zeeuw D Stehouwer CD, Gansevoort RT. The effect of metformin on blood pressure,
plasma cholesterol and triglycerides in type 2 diabetes mellitus: a systematic review. J Intern Med 2004;256:1-14.
19. Durrington PN, Tuomilehto J, Hamann A, Kallend D, Smith K. Rosuvastaitin and fenofibrate alone and in combi-
nation in type 2 diabetes patients with combined hyperlipidaemia. Diabetes Res Clin Pract 2004;64:137-51.
20. Dembowski E, Davdison MH. Statin and ezetimibe combination therapy in cardiovascular disease. Curr Opini
Endocrinol Diabetes Obes 2009;16:183-8.
21. Kamanna VS, Ganji SH, Kashyap ML. Niacin: an old drug rejuvenated. Curr Atheroscler Rep 2009;11:45=51.
22. Miller DB, Spence JD. Clinical pharmacokinetics of fibric acid derivatives (fibrates). Clin Pharmacokinet
23. Pérez-Jiménez F, Ros E, Solá R, Godás G, Pérez-Heras A, Mostaza J, Pintó X. Consejos para ayudar a controlar el
colesterol con una alimentación saludable. Clin Invest Arterioscler 2006;18: 104-10.
24. Pintó X, Meco JF. Tratamiento de la dislipemia diabética con fármacos hipolipemiantes. Nuevos conceptos. Clin
Invest Arterioscler 2004;16:160-9.
25. Miettinen H, Lehto S, Salomaa VI, Mahonem M, Niemela H, Haffner SM, et al. Impact of diabetes on mortality af-
ter the first myocardial infarction (Finmonica Miocardial Infarction Register Study). Diabetes Care 1998;21:69-75.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
USO DE ANTIAGREGANTES
La necesidad de emplear antiagregación en el paciente diagnosticado de diabetes mellitus 2 (DM2) continúa siendo
objeto de controversia. El primer aspecto a tener en cuenta es si cuando se decide antiagregar en DM2 se está hacien-
do prevención primaria o secundaria, ya que durante años, se ha considerado la DM2 como un evento cardiovascular.
Actualmente, no todos los expertos comparten este criterio y, tras la publicación de varios estudios sobre utilización de
ácido acetil salicílico en población diabética, se duda de la indicación de antiagregación en los pacientes con DM2 sin
enfermedad cardiovascular conocida.
COMPARACIÓN DE LA MORBIMORTALIDAD CARDIOVASCULAR EN PACIENTES DIABÉTICOS Y ENFER-
MOS CON CARDIOPATÍA ISQUÉMICA
Los estudios de cohorte que valoran el riesgo de eventos coronarios de pacientes diabéticos frente al de pacientes con
antecedentes de cardiopatía isquémica y frente a población general muestran un mayor riesgo coronario en el paciente
diabético respecto a la población general. El estudio de Haffner et al en población finlandesa comparando la incidencia
de infarto de miocardio (IM) y no fatal, en sujetos no diabéticos y diabéticos, mostró que la incidencia de eventos cardio-
vasculares en sujetos diabéticos sin IM previo era similar a la de los sujetos no diabéticos con IM previo, incluso después
de ajustar por tabaquismo, colesterol y cifras de presión arterial (1). No obstante, los resultados comparativos de mor-
talidad coronaria entre población diabética y población con antecedente de cardiopatía isquémica son contradictorios,
estas diferencias podrían explicarse por múltiples causas: diferencias en los criterios de inclusión, falta de uniformidad
en la definición de diabetes y de cardiopatía isquémica, forma de recoger los datos, inclusión de casos incidentes o pre-
valentes, características de los pacientes o aspectos metodológicos. Un aspecto a destacar es que la duración de la DM
es un factor de riesgo independiente (2) y que, a partir de 15 años de evolución de la enfermedad, el riesgo coronario se
iguala con los que tienen antecedentes de cardiopatía isquémica (3,4).
Las tablas de Framingham incluyen la diabetes como un factor de riesgo, tanto para la estratificación del riesgo de cardio-
patía isquémica como de ictus (5,6). Sin embargo, las tablas de valoración del riesgo de muerte por causa cardiovascular
del Proyecto SCORE excluyen la los diabéticos, considerándoles de alto riesgo en cualquier situación ya que el impacto de
la diabetes auto-informada fue reevaluado en la base de datos del SCORE y el impacto global de la diabetes en el riesgo
parece ser mayor que el estimado en la cohorte de Framingham, con un riesgo relativo de aproximadamente 5 en muje-
res y 3 en hombres (7). El Comité Interdisciplinario en Prevención Cardiovascular (CEIPC 2008), en la adaptación española
de las guías de prevención europeas, considera que no es necesario calcular el riesgo a pacientes que han padecido una
enfermedad cardiovascular, presentan DM2, diabetes tipo 1 con microalbuminuria, o niveles muy altos de uno o más
factores de riesgo, que implican, por sí mismos, un RCV elevado y requieren tratamiento y control intensivo (8).
La Guía de Práctica Clínica sobre Diabetes tipo 2, publicada en 2008 por el Ministerio de Sanidad insiste que, sobre la base
de la evidencia recogida, no puede afirmarse que el riesgo es igual en ambas poblaciones ni trasladar todas las interven-
ciones probadas a través de ensayos clínicos en prevención secundaria cardiovascular a la prevención primaria de todos
los pacientes diabéticos (9).
ENSAYOS CLÍNICOS SOBRE ANTIAGREGACIÓN PARA PREVENCIÓN PRIMARIA EN DIABETES MELLITUS
Diversos estudios han buscado el efecto de la aspirina en prevención primaria cardiovascular y han incluido gran número
de pacientes con diabetes (10-16). Dos ensayos clínicos recientes, POPADAD (Prevention of Progression of Arterial Disea-
se and Diabetes)(15) y JPAD (Japanese Primary Prevention of Atherosclerosis With Aspirin for Diabetes)(16) y uno más
antiguo, el ETDRS (Early Treatment of Diabetic Retinopathy Study)(12) incluyeron exclusivamente pacientes diabéticos.
El estudio HOT fue pionero en la valoración de la utilización de AAS en prevención primaria. Se observó que el AAS redujo
los episodios cardiovasculares un 15% (p=0,03) y los infartos de miocardio totales en un 36% (p=0,002), sin influir en los
ictus. En el subgrupo de diabéticos, la reducción del riesgo relativo fue del 23% (RR 0.77, 95% CI 0.44–1.36). No hubo di-
ferencias en las hemorragias mortales entre los grupos, aunque si se observó una mayor incidencia de sangrado no fatal
en el grupo tratado con AAS (10).
El PHS (Physicians Health Study) fue realizado exclusivamente en varones tratados con 325 mg de AAS cada 48 h. En el
grupo tratado se redujo el riesgo de infarto (RR = 0,56; IC 95% 0,45 – 0,70), beneficiándose más los mayores de 50 años.
Entre los diabéticos se halló una reducción del riesgo relativo del 41% (RR 0.59, 95% CI 0.33–1.06) de infarto de miocar-
dio fatal o no fatal (11). Posteriormente, el WHS (Women´s Health Study) en mujeres a las que se administró una dosis
menor de AAS (100 mg/48 h) mostró beneficio únicamente en la reducción del riesgo de ictus isquémico, más intenso en
el grupo de diabéticas: OR: 0,42 (IC 95%: 0,22- 0,82) (14). En ambos estudios, el riesgo de sangrados graves fue superior
con la terapia antiagregante.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Sujetos en estudio
Dosis de AAS
del seguimiento
n=18.790, 47% mujeresHTA de 50-80 años con
PAD 100-115 mmHg
> 60 años 25, 2%
Physicians Health Study
Diabetes 2% (441)
DM avanzada (83% > 10
1- IAM e ictus fatal+
Dos comp. de 325-mg
IAM e ictus no fatal+
ETDRS (1992) (12)
años de evolución),
AAS (650 mg) en dosis
retinopatía, algún FRCV
2- Muerte CI o ictus
n=4.495 (42% varones)
> 60 años 71%
Mortalidad total+ IAM
Primary Prevention
Project (PPP) (2003) (13)
Diabetes 17% (1031)
no fatal+ ictus no
> 60 años 10,3%
Mortalidad CV+ IAM
Women's Health Study
(WHS) (2005) (14)
Diabetes 2,6% (1037)
fatal y no fatal+ ictus
N=1.276 Diabéticos >40
1- IAM e ictus fatal+
IAM e ictus no fatal+
POPADAD (2008) (15)
años con enfermedad
arterial periférica
2- Muerte CI o ictus
N=2.539 Diabéticos tipo
2 sin EV conocida.
IAM fatal y no fatal+
Edad media 65 años,
ictus fatal y no fatal+
enfermedad arterial
hipercolesterolemia
(53%) o complicación
microvascular (57%)
En el PPP (Primary Prevention Project) se observó una reducción no significativa en el objetivo combinado (infarto fatal
o no) entre los diabéticos tratados con 100 mg /d de aspirina en comparación a los tratados con placebo (RR 0.50, 95% CI
0.17–1.46); pero sí existieron diferencias significativas cuando se analizó el grupo total de sujetos antiagregados (13).
El estudio ETDRS (Early Treatment of Diabetic Retinopathy Study) examinó el efecto de 650 mg/d de aspirina frente a pla-
cebo en 3.711 pacientes con diabetes tipo 1 y 2 (18-70 años) que tenían algún grado de retinopatía. Aproximadamente la
mitad de los participantes tenía enfermedad cardiovascular previa (entre la que se incluía el diagnóstico de hipertensión).
Menos del 10% tenía historia previa de infarto de miocardio o ictus y el 9% tenía claudicación intermitente. El grupo de
intervención presentó un descenso del riesgo relativo de infarto de miocardio fatal o no (RR 0.85, 95% CI 0.73–1.00). Sin
embargo, hubo mayor incidencia de ictus en el grupo tratado con aspirina, aunque la diferencia fue no significativa (RR
1.18, 99% CI 0.88 –1.58) (12).
En el año 2008 se publican dos nuevos ensayos clínicos. El POPADAD (Prevention of Progression of Arterial Disease and
Diabetes) estudió si el tratamiento con aspirina y/o antioxidantes era más efectivo que placebo en la reducción de even-
tos cardiovasculares (CV) en pacientes diabéticos (tipo 1 y 2) con enfermedad arterial periférica asintomática. Apare-
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
cieron 116 de 638 (18.2%) eventos primarios en los pacientes asignados a aspirina frente a 117 de 638 (18.3%) en el
grupo placebo (OR 0.98, 95% CI 0.76–1.26). Las tasas de todos los objetivos secundarios y de efectos adversos fueron
similares en ambos grupos, sin diferencias tampoco con relación a la utilización de tratamiento antioxidante (15). En el
JPAD (Japanese Primary Prevention of Atherosclerosis With Aspirin for Diabetes) los investigadores analizaron la eficacia
de dosis bajas de aspirina (81-100 mg/d) en la prevención primaria de eventos CV en pacientes con DM2 sin enfermedad
CV previa. No hubo diferencias en el riesgo de padecer un evento CV entre ambos grupos (HR = 0,80; IC 95%: 0,58 -1,10).
Entre las variables secundarias, únicamente se encontró diferencias estadísticamente significativas en la combinación
mortalidad coronaria y cerebrovascular (HR = 0,10; IC 95% 0,01-0,79), que fue menor en el grupo tratado con aspirina. Se
observó que los diabéticos mayores de 65 años del grupo de intervención, presentaban menor número de eventos CV
con respecto a los más jóvenes (HR = 0,68; IC 95%: 0,46-0,99) (16).
Actualmente, hay otros dos grandes ensayos en marcha investigando la utilidad de la prevención primaria con ácido
acetilsalicílico en la población diabética, el ACCEPT-D y el ASCEND. El estudio ACCEPT-D (Aspirin and Simvastatin Com-
bination for Cardiovascular Events Prevention Trial in Diabetes) investiga si 100 mg diarios de aspirina previenen los
eventos cardiovasculares en pacientes diabéticos sin manifestación clínica de enfermedad cardiovascular y tratados con
simvastatina. El estudio pretende reclutar 5.170 hombres y mujeres de edad igual o mayor a 50 años y diagnosticados de
diabetes mellitus tipo 1 o 2 ya en tratamiento con estatinas o candidatos a recibirlas (LDL-colesterol >=100 mg/dl, tras 3
meses de medidas no farmacológicas). El objetivo principal combina muerte cardiovascular, infarto fatal y no fatal, ictus
no mortal e ingreso hospitalario por causas CV (síndrome coronario agudo, ataque isquémico transitorio, revasculariza-
ción no programada, enfermedad vascular periférica) (17).
El ASCEND (Study of Cardiovascular Events in Diabetes), iniciado en 2004, se está desarrollando en Gran Bretaña, y exami-
nará también los efectos de 100 mg/d de aspirina frente a placebo en al menos 10.000 varones y mujeres mayores de 40
años con diabetes tipo 1 o 2, sin eventos CV previos en un diseño 2x2 que también valorará los efectos de los suplemen-
tos con ácidos grasos omega 3 (18).
Así pues, ninguno de los ensayos clínicos muestra resultados concluyentes. En un intento de extraer información que
sintetice los datos de los diversos estudios, se realizaron y publicaron en el año 2009 cuatro metanálisis.
METAANÁLISIS SOBRE ANTIAGREGACIÓN PARA PREVENCIÓN PRIMARIA
Publicación (año 2009)
Estudios incluidos
Aspirin in the primary and secondary
prevention of vascular disease:
collaborative meta-analysis of individual
(PHS, HOT, TPT, PPP
participant data from randomised trials.
Antithrombotic Trialists' (ATT) (19)
Aspirin for primary prevention of
cardiovascular events in people with
diabetes: metaanalysis of randomised
controlled trial. De Berardis et al (20)
Aspirin for primary prevention of
cardiovascular events
in patients with diabetes:
A meta-analysis. Zhang et al (21)
Aspirin for the Primary Prevention of
Cardiovascular Events.
A systematic review and meta-analysis
patients with and without diabetes.
Calvin et col (22)
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
El Metanálisis publicado por The Antithrombotic Trialists' (ATT) Collaboration incluía 6 de los principales estudios sobre
la utilización de aspirina en prevención primaria en población general (más de 95 000, casi 4000 sujetos con diabetes).
Se observó que la aspirina redujo el riesgo de eventos CV entorno a un 12% (RR 0.88, 95% CI 0.82– 0.94). La mayor re-
ducción fue en infarto de miocardio fatal o no fatal (RR 0.77, 95% CI 0.67– 0.89), con escaso efecto sobre la mortalidad
coronaria total (RR 0.95, 95% CI 0.78 –1.15) o sobre la incidencia de ictus totales (RR 0.95, 95% CI 0.85–1.06). El efecto
de la aspirina sobre los eventos CV mayores fue similar en los pacientes con y sin diabetes (RR 0.88, 95% CI 0.67–1.15
y RR 0.87, 95% CI 0.79–0.96, respectivamente). El intervalo de confianza fue más amplio debido al escaso número de
diabéticos y de eventos en este subgrupo. Se examinó el riesgo de sangrado, identificándose que el tratamiento con
aspirina incrementaba la incidencia de hemorragias gastrointestinales graves y extracraneales (0·10% vs 0·07% por año,
p<0·0001) (19).
En el metanálisis efectuado por De Berardis et al, en el que ya se incluyó el POPADAD y el JPAD, no se encontraron dife-
rencias estadísticamente significativas en la reducción del riesgo de eventos CV graves (5 estudios, 9584 participantes;
RR = 0.90; IC del 95% 0.81-1), mortalidad CV (4 estudios, n=8557; RR = 0.94; IC del 95% 0.72 -1.23), o mortalidad total (4
estudios, n=8557; RR = 0.93; IC del 95% 0,82 -1,05). La aspirina redujo significativamente el riesgo de infarto de miocar-
dio en varones (0.57, 0.34 - 0.94) pero no en mujeres (RR = 1.08, 0.71- 1.65; p = 0.056). No se identificó un incremento
significativo en el riesgo de sangrado (20).
Zhang et al incluyeron 9 estudios en su metanálisis. No hallaron diferencias estadísticamente significativas ni en el
riesgo de aparición de eventos CV (RR 0,92 (IC 95%: 0,83 – 1,02), ni IAM (RR 0,85; IC 95%: 0,65 – 1,11), ni ictus (RR 0,83 (IC
95%: 0,63 – 1,10), ni mortalidad total (RR 0,95; IC 95%: 0,85 – 1,05). El riesgo de sangrado grave en el grupo tratado con
aspirina fue superior (RR 2,46; IC 95%: 0,70 – 8,61) (21).
Calvin et al no encontraron diferencias estadísticamente significativas al comparar el beneficio de la aspirina entre pa-
cientes con diabetes mellitus o no para mortalidad (1.12, 95% IC 0,92–1,35), IAM (0.86, 95% IC 0,62–1,11). Tampoco para
el ictus isquémico, analizando únicamente los datos de l WHS y del JPAD (0,62, 95% IC 0,31–1,24) (22).
Estos metaanálisis poseen importantes limitaciones a la hora de interpretar los resultados de forma concluyente. Los
estudios incluidos presentan una gran heterogeneidad, difieren mucho entre ellos en cuanto a la dosis de aspirina, la
duración del seguimiento y las características de los participantes, muchos de ellos presentan problemas de potencia
estadística, y el número de eventos es escaso para estimar con precisión los efectos del tratamiento antiagregante en
el subgrupo de diabéticos.
RECOMENDACIONES SOBRE ANTIAGREGACIÓN PARA PREVENCIÓN PRIMARIA EN DIABETES MELLITUS.
1. Asociación Americana de Diabetes (ADA 2010)(23)
Se deberá considerar el tratamiento con aspirina (75 - 162 mg/día) como estrategia preventiva primaria en aquellos pa-
cientes con diabetes Tipo 1 o Tipo 2 con alto riesgo CV (riesgo a los 10 años > 10%). Este grupo incluye a la mayoría de
los varones > 50 años o mujeres > 60 años que presentan al menos un factor de riesgo principal adicional (antecedentes
familiares de enfermedad CV, hipertensión, tabaquismo, dislipemia, o albuminuria) (C).
Respecto a recomendaciones de anteriores, han cambiado aspectos importantes. La edad ya no es un requisito sufi-
ciente para antiagregar a los diabéticos en prevención primaria, sino que es necesario tener otros factores de riesgo
CV. Además, antes se consideraba para >40 años, tanto varones como mujeres. Se cuantifica el riesgo CV, previamente
únicamente se enumeraban los factores de riesgo CV. La recomendación actual es una recomendación C, mientras que
en el año 2007 comenzó siendo A, reconociendo explícitamente que la eficacia de la aspirina en la prevención primaria
en sujetos de bajo riesgo, como los varones < 50 años o las mujeres < 60 años sin otros factores de riesgo principales,
no se ha demostrado suficientemente. Se requiere el juicio clínico para los pacientes incluidos en estos grupos de edad
con otros factores de riesgo (C).
Las recomendaciones incluyen también, la antiagregación en prevención secundaria y la doble antiagregación:
• Se deberá emplear terapia con aspirina (75 - 162 mg/día) como estrategia preventiva secundaria en aquellos
pacientes con diabetes y antecedentes de enfermedad CV (A).
• Se deberá emplear clopidogrel (75 mg/día) en aquellos pacientes con enfermedad CV y alergia a la aspirina
documentada (B).
• El tratamiento combinado de AAS (75 – 162 mg/día) y clopidogrel (75 mg/día) es razonable hasta un año des-
pués de un síndrome coronario agudo (B).
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
2. A Position Statement of the American Diabetes Association, a Scientific Statement of the American Heart Association, and an
Expert ConsensusDocument of the American College of Cardiology Foundation. Documento conjunto de la ADA-AHA-ACCF
2010. (24)
Este grupo asume parte de los posicionamientos de la ADA y recomienda dosis bajas de aspirina (75 mg/d-162 mg/d)
para adultos con DM2 en prevención primaria pero con elevado riesgo CV basado en la edad (varones >50 años y mujeres
> 60 años) y la presencia de, al menos, uno de los siguientes factores de riesgo CV: tabaquismo, dislipemia, hipertensión,
historia familiar de enfermedad CV precoz o albuminuria (B,C). No recomiendan aspirina en diabéticos de alto riesgo pero
con riesgo de sangrado ni en diabéticos de bajo riesgo. Para la valoración del riesgo CV recomiendan utilizar escalas espe-
cialmente diseñadas para población diabética (UKPDS Risk Engine: http://www.dtu.ox.ac.uk/riskengine/index.php. ARIC
CHD Risk Calculator: http://www.aricnews.net/riskcalc/html/RC1.html. American Diabetes Association Risk Assessment
Tool, Diabetes PHD: http://www.diabetes.org/phd)
3. National Institute for Health and Clinical Excellence (NICE 2008)(25)
Recomiendan antiagregar con 75 mg/día de AAS a los pacientes diabéticos con 50 o más años y que mantengan su
presión arterial por debajo de 145/90 mmHg y en menores de 50 años con factores de riesgo CV (síndrome metabólico,
historia de enfermedad CV precoz, tabaquismo, hipertensión arterial, microalbuminuria).
4. Guía de Práctica Clínica sobre Diabetes Mellitus 2 del Ministerios de Sanidad 2008 (26).
Este documento insiste en que en prevención primaria, el beneficio del AAS depende del riesgo CV basal y recomienda
considerar un tratamiento con AAS y estatinas en pacientes diabéticos de más de 15 años de evolución, especialmente si
son mujeres, debido a su alto riesgo CV (C).
5 Posicionamiento REDGedaps 2010 (27)
Este grupo español de expertos en diabetes acaba de publicar su posicionamiento tras una revisión de los principales en-
sayos clínicos y metanálisis publicados recientemente, y concluyen que en el momento actual no hay ninguna evidencia
que justifique la prescripción de aspirina en el paciente con diabetes sin enfermedad CV conocida. Las intervenciones
que deben ser priorizadas en pacientes con diabetes son sobre control de la presión arterial, de los niveles de colesterol,
control glucémico y hábito tabáquico.
6. Guía Europea de Prevención Cardiovascular en la Práctica Clínica. Adaptación Española del CEIPC 2008 (8)
Este comité de expertos en prevención CV defiende que la aspirina (de por vida con dosis bajas 75-150 mg diarios) está
indicada en todos los pacientes con enfermedad CV establecida (incluidos los diabéticos), a menos que haya contrain-
dicación formal: se recomienda tratamiento. Respecto a la prevención primaria, recomiendan emplear aspirina en los
individuos asintomáticos, cuando el riesgo de enfermedad CV a 10 años está muy aumentado (SCORE 10%) y la PA esté
bien controlada.
7. Aspirin for the Prevention of Cardiovascular Disease: U.S. Preventive Services Task Force Recommendation Statement 2009
Estas recomendaciones americanas insisten en antiagregar a varones de 45 a 79 años cuando el potencial beneficio en
la prevención de infarto de miocardio (basado en la utilización de las tablas de Framingham para cardiopatía isquémica)
supere el riesgo de sangrado gastrointestinal (A) y a mujeres de 55 a 79 años cuando el potencial beneficio en la reduc-
ción de ictus isquémico (basado en la utilización de las tablas de Framingham para ictus) supere el riesgo de hemorragia
gastrointestinal (A). No encuentran evidencia suficiente para valorar el riesgo-beneficio de antiagregar a varones o muje-
res de más de 80 años y no recomiendan iniciar antiagregación en prevención primaria en mujeres menores de 55 años
o en varones menores de 45 años. (D).
1. Actualmente no existe evidencia clínica suficiente para aconsejar la utilización de antiagregación en todos los
pacientes diabéticos. El nivel de riesgo CV de cada diabético determinará la utilidad de antiagregar.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
2. Dicho nivel de riesgo CV estará condicionado por la presencia y el adecuado control de otros factores de riesgo
como la hipertensión arterial, el tabaquismo, la obesidad o la dislipemia.
3. Por otra parte, parece que existen diferencias en la respuesta a la antiagregación en varones y en mujeres.
4. Estos aspectos, y la posible concomitancia de otros tratamientos farmacológicos (estatinas, bloqueo del sistema
renina angiotensina), que no se han considerado en los estudios realizados y tampoco en los metanálisis, pueden
ser la causa de la ausencia de datos que apoyen la utilización sistemática de aspirina en los pacientes diabéticos
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
1. Haffner SM, )Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects
with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med.
2. Hu FB, Manson JE, Stampfer MJ, Colditz G, Liu S, Solomon CG, et al. Diet, lifestyle, and the risk of type 2 diabetes
mellitus in women. N Engl J Med. 2001;345(11):790-7.
3. Vaccaro O, Eberly LE, Neaton JD, Yang L, Riccardi G, Stamler J. Impact of diabe-tes and previous myocardial
infarction on long-term survival: 25-year mortality fo-llow-up of primary screenees of the Multiple Risk Factor
Intervention Trial. Arch Intern Med. 2004;164(13):1438-43. 160.
4. Wannamethee SG, Shaper AG, Lennon L. Cardiovascular disease incidence and mortality in older men with dia-
betes and in men with coronary heart disease. Heart. 2004;90(12):1398-403.
5. Wilson PW, Castelli WP, Kannel WB. Coronary risk prediction in adults (the Framingham Heart Study). Am J Car-
diol 1987; 59:91G–94G.
6. Wolf P, D'Agostino R, Belanger A, Kannel W. Probability ofStroke: a risk profile from the Framingham study. Stroke
7. Graham I, Atar D, Borch-Johnsen K, Boysen G, Burell G, Cifkova R, et al et al. European guidelines on cardiovas-
cular disease prevention in clinicalpractice: fourth joint Task Force of the European Society of Cardiology and
Other Societies on Cardiovascular Disease Prevention in Clinical Prevention in Clinical Practice (constituted by
representatives of nine societies and by invited experts). Eur J Cardiovasc Prev Rehabil 2007; 28: 2375–2414.
8. José Mª Lobos, Miguel A. Royo-Bordonada, Carlos Brotons, Luís Álvarez-Sala, Pedro Armario, Antonio Maiques,
Dídac Mauricio, Susana Sans, Fernando Villar, Angel Lizcano, Antonio Gil-Núñez, Fernando de Álvaro, Pedro Con-
té, Emilio Luengo, Alfonso del Río, Olga Cortés-Rico, Ana de Santiago, Miguel A. Vargas, Mercedes Martínez, Vi-
centa Lizarbe, en nombre del Comité Español Interdisciplinario para la Comité Español Interdisciplinario para la
Prevención Cardiovascular (CEIPC). Guía europea de prevención cardiovascular en la práctica clínica. Adaptación
española del CEIPC 2008. Rev Esp Salud Pública 2008; 82: 581-616
9. Grupo de trabajo de la Guía de Práctica Clínica sobre Diabetes tipo 2. Guía de Práctica Clínica sobre Diabetes
tipo 2. Madrid: Plan Nacional para el SNS del MSC. Agencia de Evaluación de Tecnologías Sanitarias del País Vas-
co; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
10. Hansson L, Zanchetti A, Carruthers SG, Dahlöf B, Elmfeldt D, Julius S, Me´nard J, Rahn KH, Wedel H, Westerling S.
Effects of intensive blood pressure lowering and low-dose aspirin in patients with hypertension: principal results
of the Hypertension Optimal Treatment (HOT). Lancet. 1998 13;351:1755-62.
11. Final report on the aspirin component of the ongoing Physicians' Health Study. Steering Committee of the Phy-
sicians' Health Study Research Group. N Engl J Med. 1989;321:129 –35.
12. Aspirin effects on mortality and morbidity in patients with diabetes mellitus. Early treatment diabetic retinopa-
thy study report 14. ETDRS Investigators. JAMA. 1992;268:1292–1300.
13. Sacco M, Pellegrini F, Roncaglioni MC, Avanzini F, Tognoni G, Nicolucci A, PPP Collaborative Group. Primary pre-
vention of cardiovascular events with low-dose aspirin and vitamin E in type 2 diabetic patients: results of the
Primary Prevention Project (PPP) trial. Diabetes Care. 2003;26:3264-3272.
14. Ridker PM, Cook NR, Lee IM, Gordon D, Gaziano JM, Manson JE, Hennekens CH, Buring JE. A randomized trial of
low-dose aspirin in theprimary prevention of cardiovascular disease in women. N Engl J Med. 2005;352:1293-
15. Belch J, MacCuish A, Campbell I, Cobbe S, Taylor R, Prescott R, Lee R, Bancroft J, MacEwan S, Shepherd J, Macfar-
lane P, Morris A, Jung R, Kelly C, Connacher A, Peden N, Jamieson A, Matthews D, Leese G, McKnight J, O'Brien I,
Semple C, Petrie J, Gordon D, Pringle S, Mac- Walter R. The prevention of progression of arterial disease and dia-
betes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with
diabetes and asymptomatic peripheral arterial disease. BMJ. 2008;337:a1840.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
16. Ogawa H, Nakayama M, Morimoto T, Uemura S, Kanauchi M, Doi N, Jinnouchi H, Sugiyama S, Saito Y, Japanese
Primary Prevention of Atherosclerosis With Aspirin for Diabetes (JPAD) Trial Investigators. Low-dose aspirin for
primary prevention of atherosclerotic events in patients with type 2 diabetes: a randomized controlled trial.
17. De Berardis G, Sacco M, Evangelista V, Filippi A, Giorda CB, Tognoni G, Valentini U, Nicolucci A; ACCEPT-D Study
Group. Aspirin and Simvastatin Combination for Cardiovascular Events Prevention Trial in Diabetes (ACCEPT-D):
design of a randomized study of the efficacy of low-dose aspirin in the prevention of cardiovascular events in
subjects with diabetes mellitus treated with statins. Trials. 2007;8:21-39.
18. British Heart Foundation. ASCEND. Available at: http://www.ctsu.ox.ac.uk/ascend. Accessed December 16, 2009.
19. Antithrombotic Trialists' (ATT) Collaboration, Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R,
Buring J, Hennekens C, Kearney P, Meade T, Patrono C, Roncaglioni MC, Zanchetti A. Aspirin in the primary and
secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from rando-
mised trials. Lancet. 2009;373:1849-60.
20. De Berardis G, Sacco M, Strippoli GF, Pellegrini F, Graziano G, Tognoni G, Nicolucci A. Aspirin for primary pre-
vention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ.
21. Zhang C, Sun A, Zhang P, Wu C, Zhang S, Fu M, Wang K, Zou Y, Ge J. Aspirin for primary prevention of cardiovas-
cular events in patients with diabetes: a meta-analysis. Diabetes Res Clin Pract. 2010;87:211-218.
22. Calvin AD, Aggarwal NR, Murad MH, Shi Q, Elamin MB, Geske JB, Fernandez-Balsells MM, Albuquerque FN, Lam-
propulos JF, Erwin PJ, Smith SA, Montori VM. Aspirin for the primary prevention of cardiovascular events: a sys-
tematic review and meta-analysis comparing patients with and without diabetes. Diabetes Care. 2009;32:2300-
23. American Diabetes Asociation. Executive Summary: Standards of Medical Care in Diabetes-2010. Diabetes Care.
2010; 33(suppl 1):s4-s10.
24. Pignone M, Alberts MJ, Colwell JA, Cushman M, Inzucchi SE, Mukherjee D, Rosenson RS, Williams CD, Wilson
PW, Kirkman MS. Aspirin for primary prevention of cardiovascular disease in people with diabetes: A Position
Statement of the American Diabetes Association, a Scientific Statement of the American Heart Association,
and an Expert ConsensusDocument of the American College of Cardiology Foundation. Circulation. 2010 Jun
25. NICE clinical guideline 66. Type 2 diabetes: the management of type 2 diabetes. National Institute for Health and
Clinical Excellence. Mayo 2008.
26. Grupo de trabajo de la Guía de Práctica Clínica sobre Diabetes tipo 2. Guía de Práctica Clínica sobre Diabetes
tipo 2. Madrid: Plan Nacional para el SNS del MSC. Agencia de Evaluación de Tecnologías Sanitarias del País Vas-
co; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
27. Posicionamientos 2010. RedGedaps. Disponible en http://www.redgedaps.org/index.php?idseccion=260. Con-
sultado 7 de Julio de 2010.
28. U.S. Preventive Services Task Force. Aspirin for the Prevention of Cardiovascular Disease: U.S. Preventive Services
Task Force Recommendation Statement. Ann Intern Med. 2009;150:396-404.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
ENFERMEDAD CORONARIA EN DIABÉTICOS
La diabetes mellitus (DM) es considerada actualmente como una pandemia. Además, como consecuencia del sedenta-
rismo y de la obesidad se estima que la prevalencia de la DM se irá incrementando de manera marcada en los próximos
años [1]. Diversos estudios han puesto de manifiesto que las DM incrementa el riesgo de desarrollar un evento cardio-
vascular entre 4 a 6 veces con respecto a los sujetos sin DM [2]. Las enfermedades cardiovasculares son responsables
del 75% de todas las hospitalizaciones y del 80% del total de muertes en los pacientes diabéticos [3,4]. En la mujer
diabética la protección frente a la enfermedad cardiovascular desaparece y presenta el mismo, o incluso mayor riesgo
que el hombre [4].
Aquellos pacientes que desarrollan una cardiopatía isquémica en cualquiera de sus manifestaciones clínicas y que
además son diabéticos, tienen un riesgo incrementado de presentar complicaciones, incluyendo la muerte. En los úl-
timos años ha habido un intenso debate acerca de si el ser diabético era un equivalente coronario como tal o si bien,
aunque presentaba un riesgo cardiovascular incrementado, la mortalidad coronaria era menor que la de un paciente
no diabético con infarto de miocardio previo. El debate comenzó con el estudio de Haffner y colaboradores [5] que
observaron en un registro realizado en Finlandia al comparar a casi 1.400 pacientes con infarto de miocardio frente a
algo más de 1.000 sujetos con DM, que el riesgo de muerte coronaria era similar en ambas poblaciones. Sin embargo,
posteriormente Evans y colaboradores [6] encontraron en más de 10.000 pacientes (7.414 con infarto frente a 3.477
con DM tipo 2) en Escocia que los diabéticos tipo 2 presentaron un menor riesgo cardiovascular que los pacientes con
enfermedad coronaria establecida (riesgo relativo de pacientes infartados frente a diabéticos 1,35; IC95% 1,25-2,44).
En un meta-análisis en el que se incluyeron 13 estudios con más de 45.000 pacientes se reportó que los pacientes con
DM pero sin historia de infarto de miocardio tenían un 43% menos de riesgo de desarrollar eventos coronarios que
aquellos sujetos con cardiopatía isquémica sin DM (odds ratio 0,56, IC95% 0,53-0.60) [7]. Parece que estas diferencias
encontradas en los distintos estudios se deben sobre todo a diferencias en las características basales de los pacientes
así como en el tiempo de evolución de la DM. También hay diferencias en el sexo, de forma que las mujeres diabéticas
con más de 10 años de evolución de la DM parecen tener un riesgo cardiovascular incluso superior al de las mujeres no
diabéticas con cardiopatía isquémica [8]. En cualquier caso, tener DM equivale a envejecer de manera considerable, ya
que los pacientes diabéticos tienen un riesgo de desarrollar enfermedad cardiovascular unos 15 años antes que los no
diabéticos [9].
Ante estas perspectivas, lo más razonable es tratar de evitar o al menos retrasar la aparición de cardiopatía isquémica
en el paciente diabético, principalmente mediante un abordaje multidisciplinar, con un control adecuado de todos los
factores de riesgo cardiovascular [10-13]. Ahora bien, ¿qué sucede cuado el paciente diabético tiene o ha tenido un
evento isquémico?
Los pacientes diabéticos en comparación con los que no tienen DM tienen una angina más severa, más infarto de mio-
cardio así como más disfunción ventricular izquierda. Esto se debe a múltiples motivos. De una parte, en los pacientes
diabéticos existe una alteración de la función endotelial con una reducción de la reserva del flujo coronario. Por otra
parte, existe una mayor actividad de las plaquetas, con una mayor secreción del tromboxano A2. Asimismo también
están incrementados los niveles de fibrinógeno y el factor VII, y disminuidos tanto la antitrombina III como la actividad
fibrinolítica del plasma [14,15].
Pero no sólo es que la DM por todos estos mecanismos se asocie a un mayor riesgo cardiovascular, es que además la
concomitancia de la DM con otros factores de riesgo es muy frecuente, lo que empeora todavía más la situación. Así,
la hipertensión arterial es dos veces más frecuente en los pacientes diabéticos y el riesgo de desarrollar diabetes en
los sujetos hipertensos es 2,5 veces superior en comparación con los normotensos [16]. Parece que la hiperinsulinemia
produce una activación del sistema renina-angiotensina-aldosterona que va a provocar un incremento en la expresión
de los receptores AT1 de la angiotensina II, facilitando la aparición de hipertensión arterial. Asimismo, la hiperinsuli-
nemia produce una retención de sodio y agua a nivel renal, alteraciones del intercambio iónico transmembrana, una
activación del sistema nervioso simpático y una proliferación del músculo liso de la pared arterial, produciendo un
mayor daño vascular, y de esta forma, facilitar la aparición de hipertensión arterial [17]. Es importante destacar que en
los diabéticos es más difícil alcanzar los objetivos de control de presión arterial, no sólo porque los umbrales de control
son más estrictos, sino porque frecuentemente es necesario el empleo de varios fármacos antihipertensivos [10-13].
Las alteraciones del metabolismo lipídico son frecuentes en el paciente diabético[18-20] y han sido descritas en el
apartado de DISLIPEMIA.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Por otra parte, el hábito tabáquico incrementa el riesgo cardiovascular en los sujetos diabéticos de forma más importan-
te que en los que no lo son, entre 4 y 6 veces aproximadamente, relación que es más intensa conforme se aumenta la
frecuencia y el consumo de cigarrillos. En consecuencia, es fundamental el cese inmediato del hábito tabáquico en esta
población [21].
Todos estos mecanismos explican, al menos en parte, por qué en el paciente diabético la enfermedad coronaria tiene un
peor pronóstico, con una enfermedad coronaria angiográficamente más extensa, con una mayor afectación de los pe-
queños vasos y a múltiples niveles, así como con una mayor frecuencia de enfermedad de tronco, junto con una menor
formación de vasos colaterales, una fracción de eyección más baja y una mayor tendencia a la formación de trombos
DIABETES Y SÍNDROME CORONARIO AGUDO
La DM aumenta la frecuencia de todo el espectro de la enfermedad coronaria, incluyendo el síndrome coronario agudo
[14]. De hecho, se estima que aproximadamente algo más del 20% de los pacientes con síndrome coronario agudo tie-
nen antecedentes de DM [22]. Además, existe una proporción significativa de pacientes, que en el Euro Heart Survey on
Diabetes and the Heart alcanza el 22%, de sujetos con DM no conocida y que son diagnosticados tras la realización del test
de sobrecarga oral de glucosa [23]. Por lo tanto, si se suman estas 2 cifras, alrededor del 45% de los sujetos con síndrome
coronario agudo tienen DM. En cuanto al pronóstico, los pacientes diabéticos con un infarto de miocardio tienen una
mayor mortalidad en comparación con los que no tienen DM, de tal forma que si se compara la mortalidad intrahospita-
laria de los pacientes con DM frente a los no diabéticos, en el registro GRACE ésta fue del 11,7% frente al 6,4% en el caso
del síndrome coronario agudo con elevación del ST, del 6,3% frente al 5,1% en el síndrome coronario agudo sin elevación
del ST y del 3,9% frente al 2,9% en la angina inestable [22]. Es importante destacar que no sólo existe un aumento de la
mortalidad tras un infarto agudo de miocardio en los pacientes con un diagnóstico establecido de DM, sino también en
aquellos con un nuevo diagnóstico de DM. Así, en el estudio VALIANT, que incluyó a pacientes con infarto agudo de mio-
cardio complicado con insuficiencia cardiaca o disfunción ventricular izquierda, los pacientes con un nuevo diagnóstico
de diabetes tipo 2 tuvieron las mismas tasas de reinfarto, ictus y mortalidad al año de seguimiento que los sujetos con un
diagnóstico establecido de DM [24].
Esta mayor mortalidad y esta mayor tasa de complicaciones asociadas a la DM se deben, como se comentó anteriormen-
te, a que los pacientes con DM tienen una enfermedad coronaria más difusa y extensa, una menor reserva vasodilatadora,
un descenso de la actividad fibrinolítica y un aumento de la agregabilidad plaquetaria, junto con disfunción autonómica.
Pero es que además, en estos sujetos el diagnóstico del síndrome coronario agudo es mucho más difícil de realizar, ya que
en una proporción significativa de los mismos cursa bien de manera asintomática o con síntomas poco específicos como
disnea, fatigabilidad, mareo, o síncope, entre otros [14].
Otro de los aspectos que influyen en este peor pronóstico es que, a pesar de que la cardiopatía isquémica en los diabé-
ticos es más grave y extensa, los diabéticos habitualmente reciben menos tratamientos que han demostrado un bene-
ficio clínico incuestionable, como heparinas, tratamiento fibrinolítico o intervencionismo coronario [14,25,26]. Si bien,
las evidencias científicas indican que el beneficio clínico de las terapias que han demostrado ser beneficiosas en el tra-
tamiento del síndrome coronario agudo, incluyendo la revascularización precoz, son al menos tan eficaces si no más en
la población diabética que en la no diabética [14]. Así por ejemplo, en un meta-análisis en el que se analizaron a 43.343
pacientes con infarto de miocardio, de los que aproximadamente el 10% eran diabéticos, el número de vidas salvadas por
el tratamiento fibrinolítico fue de 37 por 1.000 pacientes tratados en los diabéticos frente a 15 en los no diabéticos [27].
Por otra parte, existen multitud de datos que hablan a favor de la revascularización precoz en el paciente diabético con
síndrome coronario agudo. Así, se ha demostrado que la revascularización en los 14 días tras el infarto de miocardio cau-
só una reducción del 53% en la mortalidad anual en pacientes sin DM frente al 64% en aquellos con DM (riesgo relativo
0,36; IC95% 0,22–0,61) [28,29]. En el estudio FRISC-II, el tratamiento invasivo precoz en pacientes diabéticos con síndrome
coronario agudo sin elevación del ST o angina inestable demostró una reducción significativa de la variable combinada
muerte o reinfarto de miocardio del 39% (odds ratio 0,61; IC95% 0,36–0,54) [29]. El número necesario de pacientes a
tratar para salvar una vida o un infarto de miocardio fue de 11 para los diabéticos y de 32 para los no diabéticos.
Por lo tanto, es imprescindible una tratmiento intenso y una adecuada estratificación del riesgo en el paciente con DM y
síndrome coronario agudo, valorando la relación beneficio/riesgo de cada terapia en estos sujetos.
MANEJO DE LA CARDIOPATÍA ISQUÉMICA EN EL PACIENTE DIABÉTICO
En primer lugar, es imprescindible descartar específicamente la presencia de cardiopatía isquémica en aquellos pacientes
diabéticos con síntomas típicos o atípicos, así como en aquellos que tienen un electrocardiograma anormal en reposo. En
los que están asintomáticos, es fundamental evaluar el riesgo cardiovascular y tratar los factores de riesgo cardiovascular
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
asociados [15,30]. Por otra parte, en todo paciente con cardiopatía isquémica es importante investigar la presencia de
Si en el paciente con DM es fundamental el control global de los factores de riesgo, lo es mucho más en el diabético con
cardiopatía isquémica. En la tabla 1 se resumen los principales objetivos de control de los distintos factores de riesgo,
según las guías Europeas de Prevención para la Enfermedad Cardiovascular [14,31] y en la tabla 2 las recomendaciones
generales sobre el tratamiento del paciente diabético con cardiopatía isquémica [14]. Dado que en otra parte de esta mo-
nografía se tratan específicamente las medidas sobre el estilo de vida, y el manejo de la hipertensión arterial, glucemia,
dislipemia y antiagregantes en el paciente diabético en mayor profundidad, a continuación nos centraremos en aquellos
aspectos diferenciales en el diabético con cardiopatía isquémica.
En cuanto al control de la glucosa, es conocido que una glucemia elevada en el momento del síndrome coronario agudo,
además de ser relativamente frecuente, se asocia con un peor pronóstico y con complicaciones hospitalarias tanto en el
paciente diabético como en el no diabético [15,32]. La AHA ha realizado una serie de recomendaciones específicas acerca
del manejo de la hiperglucemia en el síndrome coronario agudo [32], que incluyen:
• Los niveles de glucosa deberían formar parte de la evaluación analítica inicial en cualquier paciente con sospecha
o con diagnóstico de certeza de síndrome coronario aguado (nivel de evidencia A).
• En pacientes ingresados en una unidad de cuidados intensivos por síndrome coronario agudo, los niveles de glu-
cosa deberían ser monitorizados estrechamente (nivel de evidencia B). Asimismo, es razonable el control inten-
sivo de la glucosa en pacientes con una hiperglucemia significativa (glucosa plasmática >180 mg/dl), indepen-
dientemente de los antecedentes de DM (nivel de evidencia B). Hasta que haya más datos disponibles, el objetivo
de glucemia a alcanzar debería ser una glucosa plasmática de 90-140 mg/dl, tratando de evitar la presencia de
hipoglucemia (nivel de evidencia C).
• La insulina, administrada en infusión intravenosa, es la forma más efectiva de controlar la glucosa en los pacientes
hospitalizados en la unidad de cuidados intensivos (nivel de evidencia B). De hecho, en el estudio DIGAMI (Diabe-
tes mellitus, Insulin Glucose Infusión in Acute Myocardial Infarction Study) el tratamiento intensivo (con perfusión
intravenosa de insulina en las primeras 24 horas tras el infarto seguido de 4 dosis de insulina al día durante tres
meses) comparado con el tratamiento convencional de la hiperglucemia en el postinfarto agudo, ha demostrado
reducir la mortalidad tanto precoz como a los 5 años [33].
• En aquellos pacientes que no ingresen en una unidad de cuidados intensivos, se debería mantener unos niveles
de glucosa <180 mg/dl, con regímenes de insulina subcutánea (nivel de evidencia C).
• En aquellos pacientes con hiperglucemia sin historia previa de DM se debería hacer una evaluación más profunda
para descartar la presencia de DM (nivel de evidencia B).
Aunque las guías europeas de hipertensión arterial señalan que los beta bloqueantes, especialmente en combinación
con un diurético tiazídico, no deberían ser empleados en pacientes con síndrome metabólico o con un riesgo incremen-
tado de padecer diabetes [34], las evidencias indican que en pacientes diabéticos con cardiopatía isquémica los beta
bloqueantes son especialmente beneficiosos [14]. De hecho, si en la población general el empleo de beta bloqueantes
tras un infarto de miocardio reduce la mortalidad total en un 23% [35], esta reducción es particularmente importante en
la población diabética [36-38], por lo que, en ausencia de contraindicaciones, en todos los pacientes con cardiopatía is-
quémica y DM los beta bloqueantes deberían emplearse [14]. En cuanto al tipo de beta bloqueantes, los beta-1 selectivos
deberían ser preferidos en el caso de pacientes en tratamiento con insulina, y los antagonistas alfa-1-beta adrenérgicos
como carvedilol podrían ofrecer beneficios adicionales en pacientes con enfermedad arterial periférica o resistencia a la
insulina aumentada [14,39]. A pesar los beneficios que tienen los beta bloqueantes en esta población, estudios realiza-
dos en nuestro país indican que el empleo de los beta bloqueantes se encuentran infrautilizados, lo que sin duda puede
conllevar importantes implicaciones pronósticas [26].
Tanto la revascularización percutánea como la quirúrgica han demostrado ser beneficiosas en la población diabética
[40]. En cuanto al intervencionismo percutáneo, el paciente diabético presenta una mayor incidencia de complicaciones.
Esto se debe, entre otros motivos, a que la enfermedad coronaria progresa más rápido en los diabéticos y los vasos son
más pequeños. Además, conviene destacar que en esta población es más frecuente la re-estenosis tras el implante de un
stent [41]. Sin embargo, hay ciertas estrategias que han permitido mejorar esta situación. Por ejemplo, se ha observado
que el empleo de los stents liberadores de fármacos frente a los convencionales parece asociarse a menos tasas de re-
estenosis. Así, en 2 ensayos clínicos aleatorizados (DIABETES, SCORPIUS), la necesidad de nueva revascularización fue de
2 a 4 veces más baja en los sujetos diabéticos tratados con los stents farmacoactivos frente a clásicos de metal [42,43].
En un meta-análisis de 12 estudios en el que se incluyeron a 1.879 sujetos con DM, se observó una reducción del 65% a
favor de los stents farmacoactivos frente a los convencionales en la necesidad de revascularización [44]. Otras acciones
como el empleo de los antagonistas de las glicoproteínas IIb/IIIa, el uso de dosis de carga con altas dosis de clopidogrel,
el empleo prolongado de la tienopiridinas o el uso de estatinas han ayudado a mejorar el pronóstico de los pacientes
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
con DM [40]. No obstante, a pesar de todas estas medidas, el riesgo de muerte, reinfarto de miocardio y necesidad de
revascularización es casi el doble en la población diabética que en la no diabética [40].
Al igual que ocurre con el intervencionismo coronario percutáneo, también el pronóstico es peor en los diabéticos tras
la revascularización quirúrgica [40]. Así, en un estudio que analizó de manera retrospectiva a 146.786 pacientes tras una
revascularización quirúrgica, se objetivó que aquellos pacientes diabéticos frente a los no diabéticos, presentaron un ma-
yor riesgo de muerte (3,7% frente a 2,7%; odds ratio ajustada 1,23, IC95% 1,15–1,32), de morbilidad (13,9% frente a 9,1%;
odds ratio ajustada 1,38, IC95% 1,33–1,44) y de infecciones (7,9% frente a 5,2%, odds ratio ajustada 1,36, IC95% 1,30–1,43)
[45]. En otro estudio realizado en 36.641 pacientes consecutivos, de los que el 31% eran diabéticos, la incidencia anual
de muerte fue de 3,1 muertes por 100 personas-año en los no diabéticos frente al 4,4 muertes por 100 personas-año en
la población diabética, cifra que ascendió a 9,4 muertes por 100 personas-año en los diabéticos que además presentaron
insuficiencia renal o enfermedad vascular periférica [46].
Ahora bien, ¿qué opción terapéutica es mejor en el paciente diabético? [47]. En el estudio BARI-2D [48] se analizó si la
revascularización percutánea o quirúrgica (a elección del médico) junto con la terapia farmacológica óptima era mejor
que el tratamiento médico óptimo en pacientes con enfermedad coronaria estable y DM tipo 2. Se incluyeron un total
de 2.368 pacientes con DM tipo 2 y enfermedad coronaria estable, documentada como una angina en clase I-II en el 82%
de los pacientes, un test de isquemia positiva y una anatomía coronaria susceptible de revascularización. Se excluyeron
a aquellos pacientes con necesidad de revascularización inmediata, enfermedad de tronco común, disnea o clase funcio-
nal III-IV o revascularización en el año previo. La variable primaria, mortalidad por cualquier causa, fue similar en ambos
grupos tras 5 años de seguimiento (hazard ratio 0,5, IC95% -2,0 a 3,1; p=0,97). Tampoco se encontraron diferencias signi-
ficativas ni en la incidencia de infarto de miocardio ni en la de enfermedad cerebrovascular. No obstante, hasta un 42% de
los pacientes del brazo de tratamiento farmacológico precisaron revascularización a lo largo del seguimiento. Asimismo,
en aquellos pacientes con una enfermedad coronaria más compleja tuvieron un mayor beneficio de la revascularización
En cuanto a cuál es el mejor procedimiento de revascularización en el paciente diabético, en un análisis post hoc del es-
tudio BARI realizado en diabéticos con enfermedad multivaso se demostró un pronóstico menos favorable en aquellos
sujetos tratados mediante revascularización percutánea frente a la quirúrgica [50]. Así, mientras que la supervivencia tras
7 años de seguimiento fue globalmente 84,4% en aquellos tratados mediante revascularización quirúrgica frente a 80,9%
en los revascularizados percutáneamente (P = 0,043), estos porcentajes bajaron en los diabéticos a 76,4 y 55,7%, respec-
tivamente (P = 0,001). Es importante destacar que en el estudio BARI la diferencia en la supervivencia se limitó a aquellos
diabéticos que recibieron al menos un injerto de mamaria interna [51]. Más recientemente, en otro estudio se analizó las
diferencias entre el intervencionismo coronario percutáneo y la revascularización quirúrgica en pacientes con DM tipo 1
y 2 y enfermedad coronaria multivaso, definida ésta como una estenosis mayor del 50% en 2 o más vasos [52]. En total se
revascularizaron quirúrgicamente a 235 pacientes y percutáneamente a 237 pacientes. Tras 5,4 años de seguimiento, no
se encontraron diferencias en la mortalidad entre ambos grupos de tratamiento. Aunque los datos procedentes de los
nuevos estudios están matizando las diferentes opciones de tratamiento de revascularización en el paciente diabético
con cardiopatía isquémica, en la tabla 3 se resumen las recomendaciones actuales sobre este punto [14].
• La DM no sólo incrementa de manera marcada el riesgo de desarrollar cardiopatía isquémica, sino que cuando
existe ésta tiene un peor pronóstico, con una mayor incidencia de complicaciones.
• Aunque las evidencias demuestran los beneficios que tienen los distintos tratamientos en el pronóstico de esta
población, la realidad nos dice desafortunadamente que estos pacientes se encuentran infratratados, lo que se
traduce en un peor control de los distintos factores de riesgo.
• En consecuencia, parece claro que es necesario mejorar la aproximación diagnóstica y terapéutica en los pacien-
tes con DM y cardiopatía isquémica, a través de un enfoque global y multidisciplinar, tratando todos los aspectos
de estos pacientes de un riesgo cardiovascular tan alto.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Tabla 1: Objetivos de control en pacientes con diabetes y cardiopatía isquémica (adaptado de 14 y 31).
Presión arterial (mmHg)
(<125/75 si insuficiencia renal, proteinuria >1 gramo/24 horas)
Control glucémico
Glucosa plasmática en ayunas (mg/dl)
Glucosa postprandial (mg/dl)
<135 en diabéticos tipo 2 (135-160 en tipo 1)
Colesterol total (mg/dl)
Colesterol LDL (mg/dl)
Colesterol HDL (hombre/mujer) (mg/dl)
Triglicéridos (mg/dl)
Cese hábito tabáquico
Actividad física regular (minutos/día)
Índice de masa corporal (Kg/m2)
Hábitos dietéticos
Ingesta de sal (gramos/día)
Ingesta de grasas (% energético de la dieta)
Ácidos grasos trans
Ácidos grasas poliinsaturados n-6
2 gramos/día de ácido linolénico y 200 mg/día de ácidos grasos
Ácidos grasas poliinsaturados n-3
de cadena muy larga
Tabla 2: Recomendaciones generales sobre el tratamiento del paciente diabético con cardiopatía isquémica (adap-
tado de 14).
Nivel de evidencia
La estratificación precoz del riesgo debería formar parte de la evaluación en el paciente diabético
tras un síndrome coronario agudo
Los diabéticos con un infarto de miocardio deberían ser considerados para el tratamiento
fibrinolítico con las mismas recomendaciones que en los no diabéticos
Cuando sea posible, a los diabéticos con síndrome coronario agudo se les debería ofrecer la
posibilidad de una coronariografía precoz y revascularización en su caso
Los beta bloqueantes reducen la morbilidad y la mortalidad en pacientes con diabetes y síndrome
Las recomendaciones sobre las indicaciones y la dosificación de la aspirina deberían ser las mismas
independientemente de la presencia de diabetes
En los pacientes diabéticos se debe considerar la adición de clopidogrel a la aspirina tras un
síndrome coronario agudo
La adición de un inhibidor de la enzima convertidora de angiotensina al tratamiento habitual
reduce el riesgo de eventos cardiovasculares en pacientes con diabetes y enfermedad
Los pacientes diabéticos con un infarto de miocardio agudo se benefician de un control estricto de
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
Tabla 3: Recomendaciones sobre la revascularización en pacientes con diabetes y cardiopatía isquémica (adaptado
de 14).
Nivel de evidencia
Las decisiones de tratamiento acerca de la revascularización en pacientes con diabetes deberían
favorecer la revascularización quirúrgica sobre la percutánea
Los inhibidores de las glicoproteínas IIb/IIIa están indicados en el intervencionismo percutáneo
electivo en el paciente diabético
Cuando se va a realizar un intervencionismo coronario percutáneo en el paciente diabético se de-
berían emplear los stents farmacoactivos
La angioplastia primaria es el método de reperfusión de elección en el paciente diabético con un
infarto agudo de miocardio
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
1. Wild S, Roglic G, Green A, Sicree R, King H. Global prevalence of diabetes. Estimates for the year 2000 and projec-
tions for 2030. Diabetes Care 2004;27:1047-53.
2. Kannel WB, McGee DL. Diabetes and glucose tolerance as risk factors for cardiovascular disease: the Fra-
mingham Study. Diabetes Care 1979;2:120-126.
3. Gray RP, Yudkin JS. Cardiovascular disease in diabetes mellitus. En: Textbook of Diabetes 2nd ed. 1997. Blackwell
4. Barret-Connor E, Wingard DL. Sex differential in ischaemic heart disease mortality in diabetics: a prospective
population-based study. Am J Epidemiol 1983;118:489-496.
5. Haffner SM, Lehto S, Rönnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects
with type 2 diabetes and in non diabetic subjects with and without prior myocardial infarction. N Engl J Med
1998;339: 229-34.
6. Evans JM, Wang J, Morris AD. Comparison of cardiovascular risk between patients with type 2 diabetes and tho-
se who had had a myocardial infarction: cross sectional and cohort studies. Br Med J 2002;324:939-42.
7. Bulugahapitiya U, Siyambalapitiya S, Sithole J, Idris I. Is diabetes a coronary risk equivalent? Systematic review
and meta-analysis. Diabet Med 2009;26:142-8.
8. Hu FB, Stampfer MJ, Solomon CG, Liu S, Willett WC, Speizer FE, et al. The impact of diabetes mellitus on mortality
from all causes and coronary heart disease in women: 20 years of follow-up. Arch Intern Med 2001;161:1717-23.
9. Booth GL, Kapral MK, Fung K, Tu JV. Relation between age and cardiovascular disease in men and women
with diabetes compared with non-diabetic people: a population-based retrospective cohort study. Lancet
10. Escobar C, Barrios V, Calderón A, Llisterri JL, García S, Rodríguez-Roca GC, et al. Diabetes mellitus en la pobla-
ción hipertensa asistida en Atención Primaria en España. Grado de control tensional y lipídico. Rev Clin Esp
11. Barrios V, Campuzano R, Guzmán G. Diabetes y corazón. Hipertensión 2002;19:28-39.
12. Barrios V, Escobar C. Diabetes and hypertension. What is new? Minerva Cardioangiol. 2009;57:705-22.
13. Escobar C, Barrios V. Diabetes and hypertension: which is the best approach? Expert Rev Cardiovasc Ther.
14. Ryden L, Standl E, Bartnik M, Van den Berghe G, Betteridge J, de Boer MJ, et al; The Task Force on Diabetes and
Cardiovascular Diseases of the ESC and EASD. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases:
executive summary. Eur Heart J 2007;28:88-136.
15. American Diabetes Association. Standards of medical care in diabetes-2010. Diab Care 2010;33 Suppl 1:S11-S61.
16. Sowers JR, Epstein M. Diabetes mellitus and associated hypertension, vascular disease and nephropathy: an
update. Hypertension 1995; 26: 869-879.
17. Palma JL, Calderón A. Hipertensión arterial y diabetes. Síndrome metabólico. Obesidad. En: Manual de hiperten-
sión arterial. Grupo Acción Médica. Sociedad Española de Cardiología, 2006;355-366.
18. Feingold KR, Grunfeld C, Pang M, Doerrler W, Krauss RM. LDL subclass phenotypes and triglyceride metabolism
in non-insulin dependent diabetes. Arterioscler Thromb 1992;12:1496-1502.
19. Llyons TJ. Lipoprotein glycation and its metabolic consequences. Diabetes 1992;41(suppl. 2):67-73.
20. Grundy S, Cleeman J, Bairey CN, Bryan H, Clark LT, Hunninghake DB, et al. Implications of recent clinical trials for
national cholesterol education program adult treatment panel III guidelines. Circulation 2004;110: 227-39.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
21. Stamler J, Vaccaro O, Neaton JD, Wentworth D. Diabetes, other risk factors and 12-years cardiovascular mortality
for men screened in the Multiple Risk Factor Intervention Trial. Diabetes Care 1993;16:434-444.
22. Franklin K, Goldberg RJ, Spencer F, Klein W, Budaj A, Brieger D, et al; GRACE Investigators. Implications of diabe-
tes in patients with acute coronary syndromes. The Global Registry of Acute Coronary Events. Arch Intern Med
23. Bartnik M, Ryden L, Ferrari R, Malmberg K, Pyorala K, Simoons ML, et al, on behalf of the Euro Heart Survey Inves-
tigators. The prevalence of abnormal glucose regulation in patients with coronary artery disease across Europe.
Eur Heart J 2004;25:1880–1890.
24. Aguilar D, Solomon SD, Kober L, Rouleau JL, Skali H, McMurray JJ, et al. Newly diagnosed and previously known
diabetes mellitus and 1-year outcomes of acute myocardial infarction: the VALsartan In Acute myocardial iNfarc-
Tion (VALIANT) trial. Circulation 2004;21:1572–1578.
25. Gitt AK, Schiele R, Wienbergen H, Zeymer U, Schneider S, Gottwik MG, et al; MITRA Study. Intensive treatment
of coronary artery disease in diabetic patients in clinical practice: results of the MITRA study. Acta Diabetol
26. Barrios V, Escobar C, Calderon A, Echarri R. Gender differences in the management of diabetic patients with hy-
pertension and chronic ischemic heart disease. The Open Diabetes Journal 2009; 2: 1-4.
27. Fibrinolytic Therapy Trialists (FFT) Collaborative Group. Indication for fibrinolytic therapy in suspected acute
myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomized
trials of more than 1000 patients. Lancet 1994;343:311–322.
28. Stenestrand U, Wallentin L. Early revascularisation and 1-year survival in 14-day survivors of acute myocardial
infarction: a prospective cohort study. Lancet 2002;359:1805–1811.
29. Lagerqvist B, Husted S, Kontny F, Naslund U, Stahle E, Swahn E, et al and the FRISC-II Investigators. A long-term
perspective on the protective effects of an early invasive strategy in unstable coronary artery disease. J Am Coll
30. Young LH, Wackers FJ, Chyun DA, Davey JA, Barrett EJ, Taillefer R, et al. Cardiac outcomes after screening for as-
ymptomatic coronary artery disease in patients with type 2 diabetes: the DIAD study: a randomized controlled
trial. JAMA. 2009;301:1547-55.
31. De Backer G, Ambrosioni E, Borch-Johnsen K, Brotons C, Cifkova R, Dallongeville J, et al; Third Joint Task Force of
the European and other Societies. European Guidelines on Cardiovascular Disease Prevention. Eur J Cardiovasc
Preven Rehab 2003;10(Suppl. 1):S1–S78.
32. AHA scientific statement. Hyperglycemia and acute coronary syndrome. Circulation 2008;117;1610-9.
33. Malmberg K for DIGAMI Study Group. Prospective randomised study of intensive insulin treatment on long term
survival after acute myocardial infarction in patients with diabetes mellitus. Br Med J 1997; 314: 1512-1515.
34. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al. 2007 Guidelines for the manage-
ment of arterial hypertension: The task force for the management of arterial hypertension of the European So-
ciety of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007;25:1105-87.
35. Freemantle N, Cleland J, Young P, Mason J, Harrison J. Beta blockade after myocardial infarction. Systematic re-
view and meta regression analysis. Br Med J 1999;318:1730–1737.
36. Malmberg K, Herlitz J, Hjalmarson A, Ryden L. Effects of metoprolol on mortality and late infarction in diabe-
tics with suspected acute myocardial infarction. Retrospective data from two large scale studies. Eur Heart J
37. Kjekshus J, Gilpin E, Blackey AR, Henning H, Ross J. Diabetic patients and beta-blockers after acute myocardial
infarction. Eur Heart J 1990;11:43–50.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Guías de Actuación sobre Riesgo Cardiovascular en Enfermos Diabéticos
38. Jonas M, Reichel-Reiss H, Boyko V, Shotan A, Mandelzweig L, Goldbourt U, et al. for the Bezafibrate Infarction
Prevention (BIP) Study Group. Usefulness of beta-blocker therapy in patients with non-insulin-dependent diabe-
tes mellitus and coronary artery disease. Am J Cardiol 1996; 77:1273–1277.
39. Gheorghiade M, Goldsten S. Beta-blockers in the post-myocardial infarction patient. Circulation 2002;106:394–
40. Cook S, Windecker S. Revascularisation of coronary artery disease in patients with diabetes mellitus. Swiss Med
Wkly 2009; 139: 654-64.
41. Wenaweser P, Daemen J, Zwahlen M, van Domburg R, Juni P, Vaina S, et al. Incidence and Correlates of Drug-
Eluting Stent Thrombosis in Routine Clinical Practice: 4-Year Results From a Large 2-Institutional Cohort Study. J
Am Coll Cardiol 2008;52:1134–40.
42. Sabate M, Jimenez-Quevedo P, Angiolillo DJ, Gomez-Hospital JA, Alfonso F, Hernandez-Antolin R, et al. Randomi-
zed Comparison of Sirolimus-Eluting Stent Versus Standard Stent for Percutaneous Coronary Revascularization
in Diabetic Patients: The Diabetes and Sirolimus-Eluting Stent (DIABETES) Trial. Circulation 2005;112:2175–83.
43. Baumgart D, Klauss V, Baer F, Hartmann F, Drexler H, Motz W, et al. One-Year Results of the SCORPIUS Study: A
German Multicenter Investigation on the Effectiveness of Sirolimus-Eluting Stents in Diabetic Patients. J Am Coll
44. Stettler C, Allemann S, Wandel S, Kastrati A, Morice MC, Schomig A, et al. Drug eluting and bare metal stents in
people with and without diabetes: collaborative network meta-analysis. Br Med J 2008;337:a1331.
45. Carson JL, Scholz PM, Chen AY, Peterson ED, Gold J, Schneider SH. Diabetes mellitus increases short-term morta-
lity and morbidity in patients undergoing coronary artery bypass graft surgery. J Am Coll Cardiol 2002;40:418–
46. Leavitt BJ, Sheppard L, Maloney C, Clough RA, Braxton JH, Charlesworth DC, et al. Effect of Diabetes and Asso-
ciated Conditions on Long-Term Survival After Coronary Artery Bypass Graft Surgery. Circulation 2004; 110(11
Suppl 1):II-41–4.
47. Pfisterer ME, Zellweger MJ, Gersh BJ. Management of stable coronary artery disease. Lancet 2010; 375: 763–72.
48. BARI 2D Study Group, Frye RL, August P, Brooks MM, et al. A randomized trial of therapies for type 2 diabetes and
coronary artery disease. N Engl J Med 2009; 360: 2503–15.
49. Chaitman BR, Hardison RM, Adler D, Gebhart S, Grogan M, Ocampo S, et al. The Bypass Angioplasty Revascula-
rization Investigation 2 Diabetes randomized trial of different treatment strategies in type 2 diabetes mellitus
with stable ischemic heart disease. Impact of treatment strategy on cardiac mortality and myocardial infarction.
Circulation 2009; 120: 2529–40.
50. The BARI Investigators. Seven-year outcome in the bypass angioplasty revascularization investigation (BARI) by
treatment and diabetic status. J Am Coll Cardiol 2000;35:1122–1129.
51. The BARI Investigators. Influence of diabetes on 5-year mortality and morbidity in a randomized trial comparing
CABG and PTCA in patients with multivessel disease: the Bypass Angioplasty Revascularization Investigation
(BARI). Circulation 1997;96:1761–1769.
52. Kapur A, Bartolini D, Finlay MC, Qureshi AC, Flather M, Strange JW, et al. The Bypass Angioplasty Revasculari-
zation in Type 1 and Type 2 Diabetes Study: 5-year follow-up of revascularization with percutaneous coronary
intervention versus coronary artery bypass grafting in diabetic patients with multivessel disease. J Cardiovasc
Med (Hagerstown) 2010;11:26-33.
Sociedad Española de Hipertension - Liga Española para la Lucha Contra la Hipertensión Arterial
Source: http://files.socextremehta.webnode.es/200000022-b9af0baa92/LibroDiabetes_1-11%202%20parte.pdf
comexane.com.mx
CONSEJO DIRECTIVO COLEGIO MEXICANO DE ANESTESIOLOGÍA, A.C. Dr. José A. Castelazo Arredondo Presidente Electo Dr. Juan H. Muñoz Cuevas Primer Secretario Propietario Dra. Hortensia Ayón Villanueva Primer Secretario Suplente ACAD. DR. JAIME RIVERA FLORES Dra. Arizbe Rivera Ordóñez Segundo Secretario Suplente Dra. Laura P. González Aquino EPOCA II VOL. VIII NO. 2
sigmabooks.co.kr
Albala, Ken. Beans: A History. Berg, 2007 Allen, Stewart Lee. In the Devil's Garden: A Sinful History of Forbidden Food. Ballantine Books, 2002. Andrews, Jean. Peppers: The Domesticated Capsicums. University of Texas Press, 1984. Barkas, Janet. The Vegetable Passion. Charles Scribner, 1975. Behr, Edward. The Artful Eater. Art of Eating, 2004.