Lungentransplantation
Lung TransplantationU. Sommerwerck1, T. Rabis1, H. Carstens2, H. Teschler1, M. Kamler2
Affiliations
1 Abteilung Pneumologie-Universitätsklinik, Ruhrlandklinik, Westdeutsches Lungenzentrum am Universitätsklinikum Essen, Universität Duisburg-Essen 2 Abteilung für thorakale Transplantation, Westdeutsches Herzzentrum, Universitätsklinikum Essen, Universität Duisburg-Essen Dr. Urte Sommerwerck Abteilung Pneumologie-Universitätsklinik Westdeutsches Lungenzentrum am Universitätsklinikum Essen Universität Duisburg-Essen Tüschener Weg 40 Die Lungentransplantation (LuTX) ist eine Therapiemöglichkeit für Patienten mit terminalen Lungenerkrankungen. Die Kandidatenauswahl erfordert eine sorgsame Abwägung der krankheitsspezifischen Indikationen und Kontraindikationen für die einzelnen Erkrankungen. In der Auswahl der Patienten konnten durch die Einführung des Lung Al ocation Scores (LAS) deutliche Fortschritte gemacht werden, in dem sowohl die Dringlichkeit als auch das Überleben nach LuTX unter Vernachlässigung der Wartezeit in die Entscheidungsfindung einbezogen wurde. Durch das LAS- System konnte die Wartelistensterblichkeit reduziert werden. Die Verfügbarkeit von Spenderorganen kann möglicherweise durch die Ex-vivo- Lungenperfusion als Alternative zur konventionellen Konservierung erhöht werden. Es wurden Risikofaktoren für schlechte Überlebensraten nach LuTX definiert. Unser Verständnis für physiologische, zelluläre und molekulare Ursachen der Lungen- und Atemwegsschäden konnte erweitert werden. Primäres Organversagen, Infektionen, zelluläre und humorale Abstoßungsreaktionen, lymphozytische Bronchiolitis sowie die chronische Abstoßungsreaktion mit ihren Phänotypen Bronchiolitis obliterans Syndrom und Restriktivem Al ograftsyndrom (RAS) sind inzwischen gut charakterisierte Komplikationen nach LuTX und Ursache für Erkrankungen und Mortalität. Dieses Kapitel bietet eine umfangreiche Darstellung neuer Entwicklungen auf diesen Gebieten für den Kliniker, der nicht täglich mit transplantierten Patienten umgeht. Abstract
Lung transplantation is a therapeutic option for patients with end-stage lung diseases. Selection of candidates requires careful consideration about the disease-specific indications and contraindications for transplantation. Advances have been made in candidate selection via the ability to prognosticate outcomes of various lung diseases and through the implementation of the Lung Al ocation Score (LAS) with specific consideration of high urgency and good postoperative survival rate, neglecting the waiting time. This system has resulted in decreased mortality on the list for lung transplantation. The availability of donor organs can possibly be increased by implementation of the ‘ex-vivo-lung perfusion' as an alternative to conventional organ preservation. Risk factors for poor outcomes post-lung transplantation have been identified and our understanding of the physiological, cellular, and molecular mechanisms responsible for lung and airway damage has substantially been expanded. Primary graft dysfunction, infectious diseases, acute rejection, antibody-mediated rejection, lymphocytic bronchiolitis, obliterative bronchiolitis, restrictive allograft syndrome, and chronic lung allograft dysfunction are well defined complications and continue to be common causes of morbidity and mortality. This chapter provides a comprehensive update on these topics for the non-transplant clinician. Schlüsselwörter: Lungentransplantation, Al okations-Score, Abstoßung, chronische
Organdysfunktion Keywords: lung transplantation, lung allocation score, graft rejection, chronic lung allograft
Die Lungentransplantation (LuTX) ist eine etablierte Therapieoption im Endstadium verschiedener pulmonaler Erkrankungen. Die Überlebensrate hat sich im Laufe der Jahre stetig verbessert, so dass diese Form der Behandlung heute berücksichtigt werden sollte, wenn alle anderen Therapiemöglichkeiten ausgeschöpft sind. Das Langzeitüberleben ist jedoch verglichen mit anderen Organtransplantationen deutlich schlechter. Nach Angaben der International Society of Heart and Lung Transplantation (ISHLT) überleben 79 % der Patienten im ersten Jahr, 71 % nach 3 Jahren, 53 % nach 5 Jahren und lediglich 31 % nach 10 Jahren . Zum Vergleich ist die 5-Jahresüberlebensrate bei Herztransplantationen mit 72 % deutlich besser . Derzeit werden international etwa 3700 Lungentransplantationen im Jahr, in Deutschland etwa 300 Transplantationen durchgeführt . Indikation zur Lungentransplantation
Die Indikation zu einer Lungentransplantation besteht prinzipiell bei allen diffusen Lungenkrankheiten mit schwer eingeschränkter Lebensqualität infolge respiratorischer Insuffizienz (NYHA III) natürlicher 2-Jahresüberlebensrate ohne LuTX niedriger als 50 % und ausgeschöpfter konservativer Therapie Alter bis 65 Jahre (abhängig vom biologischen Alter und den Komorbiditäten). Die häufigsten Indikationen zur LuTX sind das Lungenemphysem (COPD und 1-Antitrypsinmangel) (33%), die Mukoviszidose (Zystische Fibrose) (26%) und die Lungenfibrose (17%) . Die Indikationen und Kontraindikationen wurden im einzelnen ausführlich beschrieben . Besteht die prinzipielle Indikation zur Listung für eine Lungentransplantation und liegen keine absoluten Kontraindikationen vor, sollte der Patient in einem Transplantationszentrum vorgestellt werden. Dazu reicht zunächst eine Basisdiagnostik (Lungenfunktion aktuel und vor 6 Monaten, letzter Arztbrief), die dem Zentrum zugesandt werden kann. Stimmt das Transplantationszentrum aufgrund der Basisdiagnostik einer weiteren Begutachtung zu, werden insbesondere neben der Prüfung der einzelnen Organbefunde die Adhärenz und die soziale Einbindung des Patienten geprüft. Die Entscheidung über die Listung zur Lungentransplantation wird in einer interdisziplinären Konferenz nach dem 6-Augenprinzip gefällt (Transplantationschirurg, Pneumologe und ein nicht zum Transplantationsprogramm gehöriger Arzt ).
Organangebot
Das Organangebot ist für die Lunge begrenzt, weil in Deutschland nur bei etwa 20 % der Multiorganspender eine Lungenentnahme durchgeführt werden kann, da die Anforderungen an ein ‚ideales‘ Organ häufig nicht gewährleistet werden können. Die Lunge ist das Organ, welches immer mit der Umwelt kommuniziert und jederzeit der Gefahr einer Infektion ausgesetzt ist. Außerdem unterliegen die Organspender häufig einer Langzeitbeatmung, die per se zu einer Verschlechterung des Spenderorgans führt. Durch Erweiterung der Spenderkriterien (extended donors) konnte eine Verfügbarkeit von über 40 % ohne Verschlechterung des Outcomes erreicht werden. So hat sich gezeigt, dass auch die Verwendung reanimierter Spender mit guter Ergebnisqualität möglich ist, doch ist die Lungenspende nach Kreislaufstil stand in Deutschland insbesondere aus ethischen Bedenken gegenüber der Frage, wann Reanimationsmaßnahmen eingestellt werden und die Explantation der Lunge erfolgt, bisher nicht zugelassen . Desweiteren wurden die Organperfusionslösungen durch Radikalenfänger optimiert . In den letzten Jahren wurden zunächst experimentell und dann beim Menschen Organaufbereitungssysteme bei grenzwertigen Organen (z.B. Ex-vivo lung perfusion, organ care system) eingesetzt, die nach Aufbereitung eine zur üblichen Organpreservation vergleichbare Rate an primärem Organversagen zeigten . Damit konnte das Organangebot vergrößert werden . Organverteilung (Allokation)
Liegen alle Voraussetzungen für eine Transplantation vor, kann der Patient an Eurotransplant gemeldet werden. Dort werden alle potenziellen Empfänger von Spenderorganen erfasst sowie die Verteilung der Spenderorgane koordiniert. Die Zahl der Wartelistenkandidaten hat international jedes Jahr weiter zugenommen. Derzeit warten mehr als 600 Patienten in Deutschland auf eine Lunge, transplantiert werden etwa 300 Patienten. Aufgrund der langen Wartezeiten und der hohen Wartelistenmortalität wurde 2005 in den USA der Lung Al ocation Score (LAS) eingeführt. Auf der Grundlage von retrospektiven Analysen der Wartelistenmortalität der vier großen Indikationsgruppen COPD, pulmonalarterieller Berechnungsmodelle entwickelt, die zu einer Priorisierung von Patienten mit hoher Dringlichkeit und guter postoperativer Überlebensrate unter Vernachlässigung der Wartezeit führten . Der LAS, der einen Wert zwischen 0 und 100 annehmen kann, wird aus verschiedenen Messwerten wie z.B. der forcierten Vitalkapazität (FVC), der 6-Minuten Gehstrecke (6MWT), der Sauerstoffflussrate für eine ausreichende Oxigenierung und dem funktionellen Status des Patienten durch ein komplexes Rechenmodell ermittelt (Tabelle 1).
Durch die Umsetzung des LAS kam es zu einer Zunahme der Empfänger mit idiopathischer Lungenfibrose (IPF). Aktuel ist die IPF die häufigste Indikation zur Lungentransplantation in den USA. Gleichzeitig konnte die Wartelistensterblichkeit gesenkt werden.
Tabelle 1: Der Lung Al ocation Score (LAS)
Bereits die ersten Schritte in der Lungentransplantation sind häufig für das langfristige
Ergebnis von entscheidender Bedeutung. Zu diesen ersten Schritten gehören die Qualität und Präservation des Transplantats, der Transport und die Reperfusion des Organs sowie das optimale Management des Organempfängers in der Prätransplantationsphase.
Entnahme und Donormanagement
Bei der Spenderevaluation werden die Blutgruppe und das Hirntodprotokoll, das in doppelter
Ausfertigung vorliegen muss, sowie die Einverständniserklärung des Patienten oder der Angehörigen überprüft. Wenn die gründliche Evaluation des Spenders (Anamnese, Röntgen- Thorax, Bronchoskopie, visuel e und manuel e Inspektion) keine Kontraindikationen ergibt, kann die Organentnahme beginnen. In der Regel handelt es sich um Multiorganspender mit überwiegend subarachnoidaler Blutung als Todesursache. Die Optimierung der Lungenfunktion des Spenders erfolgt im Einklang mit den anderen Disziplinen. Dazu gehören medikamentöse Behandlungen, Volumenmanagement, Applikation von Diuretika zur Verbesserung der Lungenfunktion, Optimierung der Beatmung, Applikation von Antibiotika, Bronchoskopie und Reinigen der Mundhöhle. Je früher ein gezieltes Donormanagement durchgeführt wird, desto höher ist die Entnahmerate der Organe. Die Techniken der Organentnahme und Implantation wurden von unserer Arbeitsgruppe im Detail beschrieben ,. Aus diesem Grund erfolgt nur eine kurze Zusammenfassung: Mediane Sternotomie, Anschlingen der Vena cava superior (VCS) und inferior (VCI), Kanülierung der Aorta zur Applikation von kardioplegischer Lösung und Einführen einer Perfusionskanüle in den Hauptstamm der Pulmonalarterie. Applikation von Heparin und Ligatur der Hohlvenen. Eröffnen des linken Vorhofs, um einen freien Abfluss der Lungenperfusionslösung zu gewährleisten. Anschließend Abklemmen der Aorta und Instillation die Perfusionslösungen für Herz und Lungen bei fortgesetzter Ventilation mit 50% Sauerstoff. Nach Explantation des Herzens wird zusätzlich eine selektive retrograde Perfusion der einzelnen Lungenlappen mit je ca. 200 ml Perfusionslösung durchgeführt. Anschließend werden die beiden Lungenflügel aus dem Thorax herausgetrennt und die Trachea wird ca. 3 – 4 Ringe oberhalb der Carina abgetrennt. Die Explantate werden anschließend bei ca. 4 – 5 °C transportiert. Die angestrebte Ischämiezeit sollte unter 6 Stunden liegen. Das relative Risiko für die 1-Jahres-Sterblichkeit erhöht sich ab einer Ischämiezeit von 4,5 Std . Während bisher die Kälteperfusion und Lagerung des Organs während des Transports der Standard war, sind aktuel neue Verfahren wie die ex vivo Lungenperfusion und andere Organ Care Systeme in Erprobung, bei denen das Explantat in einem Inkubator perfundiert, ventiliert und kontinuierlich hinsichtlich seiner Funktion überprüft wird . Mit Hilfe dieser Systeme soll es gelingen, möglicherweise primär nichttransplantable Lungen soweit zu rekonstituieren, dass sie anschließend für die Transplantation zur Verfügung stehen und außerdem die Zeit bis zur Implantation um Stunden bis Tage verlängern. Die Implantation wird üblicherweise über eine bilaterale Thorakotomie mit querer Sternotomie durchgeführt. Zunehmend kommt jedoch auch die bilaterale sequentiel e Technik zum Einsatz, bei der die Lungen über zwei antero-laterale Thorakotomien (das Sternum schonend) in Folge implantiert werden . Zunächst Eingehen in den 5. ICR beidseits, Clipping der Arteria thoracica interna beidseits und quere Sternotomie. Nun, falls erforderlich, Anschließen der Herz- Lungenmaschine und Beginn der extrakorporalen Zirkulation in Normothermie. Unter dem Schutz der extrakorporalen Zirkulation (EKZ) Beendigung der Beatmung und Pneumektomie. Nach entsprechender Vorbereitung der Spenderlunge Implantation der Pars membranacea mit fortlaufender Naht, gefolgt von Einzelknopf- oder Z-Nähten des Bronchus in End zu End Technik. Anschließend Anastomosierung der Pulmonalarterie und des Lungenvenenfaches oder der Lappenvenen mit monofiler Naht. Anlage einer jeweils apikalen und dorsalen Pleuradrainage. Schichtweiser Thoraxverschluss mit -Z-Nähten des Sternums 2-fach sowie perikostalen Nähten, was einen sicheren Thoraxverschluss ermöglicht. Die Verwendung eines kardiopulmonalen Bypasses ist bei unilateraler Lungentransplantation in der Regel nicht erforderlich. Letztlich ist jede Methode in der Hand des erfahrenen Chirurgen mit guten Ergebnissen einsetzbar.
Perioperative Betreuung
Mindestens ebenso bedeutsam wie die optimale Konservierung der Spenderlungen ist die
optimale Vorbereitung des Transplantatempfängers. Mit Weiterentwicklung der extrakorporalen Membranoxygenation (ECMO) als Lungenersatzverfahren auf Zeit ist es möglich geworden, Patienten im Endstadium ihrer Erkrankung auch ohne Intubation bis zur Transplantation wach am Leben zu halten. Über eine Fal serie von 31 Patienten, die mit ECMO behandelt und transplantiert wurden, berichteten Hoopes und Mitarbeiter. Die Dauer an der ECMO betrug im Mittel 14 Tage, maximal sogar 53 Tage und das Überleben nach 1, 3 und 5 Jahren ergab keinen signifikanten Unterschied gegenüber Notfalltransplantationen im ISHLT-Register ohne ECMO-Einsatz. Allgemeine Nachsorge nach Lungentransplantation
Nach Lungentransplantation ist eine lebenslange Nachsorge zur Steuerung der immunsuppressiven Therapie und zur Erkennung und Behandlung von Komplikationen erforderlich. Diese Nachsorge wird vom Transplantationszentrum oder in enger Kooperation mit diesem übernommen. Die Durchführung einer wirksamen Immunsuppression ist wichtigste Voraussetzung für das erfolgreiche Management des Transplantatempfängers. Neben frühen postoperativen Komplikationen durch die Operation selbst oder durch eine Transplantatabstoßung Atemwegskomplikationen insbesondere an den Anastomosen, Infektionen mit Bakterien, Viren, Pilzen und das chronische Transplantatversagen die Haupttodesursachen. Die Standardimmunsuppression nach erfolgreicher Lungentransplantation besteht in einer Dreifachkombination aus Prednisolon plus einem Calcineurininhibitor (CNI) (Cyclosporin A oder Tacrolimus (TAC)) plus einem Zel zyklusinhibitor (Azathioprin (AZA) oder Mykophenolat-Mofetil (MMF)) . Die niedrigsten akuten Abstoßungsraten zeigten dabei die Kombination TAC/MMF <TAC/AZA < CSA/MMF < CSA/AZA . In einer randomisierten Studie untersuchten Treede und Kollegen erstmals, ob TAC möglicherweise vorteilhaft ist im Vergleich zu Cyclosporin A . Auffällig war, dass mehr Patienten mit Tacrolimus als mit Cyclosporin A protokollgerecht behandelt werden konnten und das die kumulative Inzidenz eines BOS und einer akuten Abstoßung unter TAC signifikant niedriger als unter Cylosporin A war, ohne dass sich das Ein- und Dreijahresüberleben signifikant unterschieden, so dass in der Gesamtschau beide Immunsuppressiva weiterhin nach LuTX eingesetzt werden Moderne Regime kombinieren CNI mit mTOR-Inhibitoren bzw. Proliferationsinhibitoren wie Sirolimus und Everolimus, um bei gleichem Risiko einer ACR eine deutlich niedrigere Nebenwirkungsrate an Niereninsuffizienz hervorzurufen . Diese Substanzen reduzieren zumindest nach Nierentransplantation und auch bei Lungentransplantation die Rate sekundärer Hauttumoren und die Größe von Angiomyolipomen bei der Lymphangioleiomyomatose, einer seltenen Indikation zur LuTX . Eine Induktionstherapie wird uneinheitlich durchgeführt und ist Zentrumsentscheidung. Die Applikation von IL-2-Rezeptorantagonisten (z.B. Basiliximab) ist mit niedrigeren akuten Abstoßungsraten im ersten Jahr im Vergleich mit fehlender Induktion oder Induktion mit Antithymocytenglobulin (ATG) oder Alemtuzumab vergesel schaftet . Bei Untergruppen wie der Mukoviszidose mit einem mutmaßlich überschießendem Immunstatus zeigte sich ein eindeutiger Vorteil in der Durchführung der Induktion mit ATG im Vergleich zu fehlender Induktion . Das Monitoring der Immunsuppressivaspiegel im Blut gibt dem Transplantationsmediziner Hinweise, wie die Immunsuppression gesteuert werden soll. Al erdings ist immer die individuelle Situation des Patienten z.B. mit wiederholten Abstoßungen, Infektionen oder bakterieller Besiedlung zu berücksichtigen. Das Ziel ist also eine individualisierte Immunsuppression. Infektionen
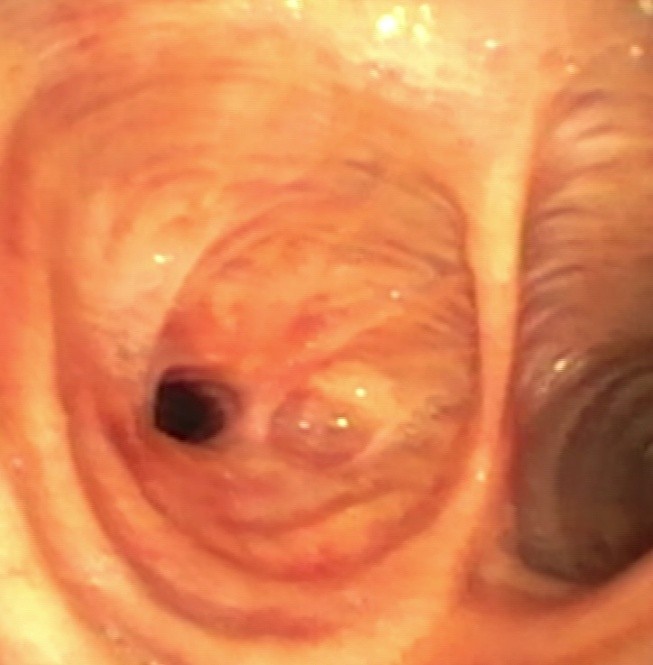
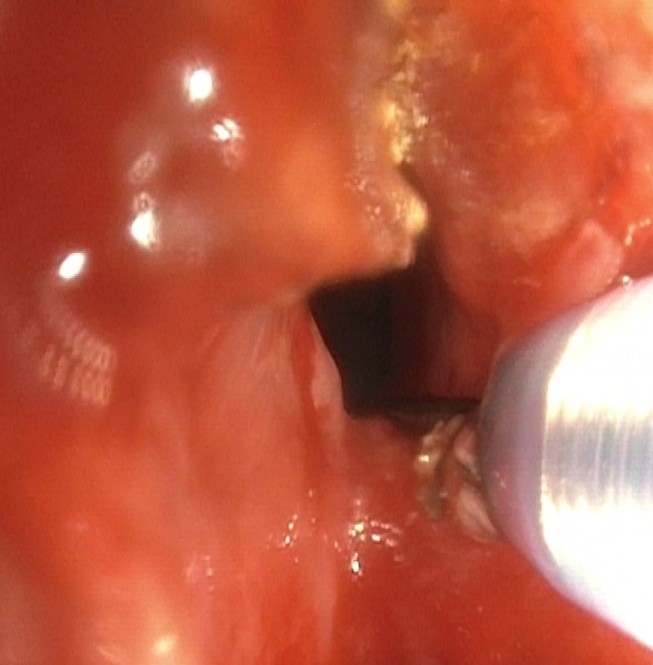
Durch die Notwendigkeit der Immunsuppression kommt es zu gehäuften Infektionen sowohl in der Früh- als auch in der Spätphase nach Lungentransplantation. Dabei spielen die gestörte mukociliäre Clearance, der eingeschränkte Hustenstoß, eine Beatmung, ein gestörter Lymphabfluß nach Transplantation sowie Schluckstörungen mit Aspiration eine entscheidende Rolle. Die meisten Infektionen treten im transplantierten Organ auf, weil es direkt nach der Transplantation mit der Umwelt kommuniziert. Die häufigsten Pathogene sind Pseudomonas aeruginosa und Staph. aureus. Da oft eine typische Klinik mit Husten oder Fieber fehlt, ist bei jeder Verschlechterung des Befindens mit respiratorischen Symptomen eine Bronchoskopie mit bronchoalveolärer Lavage (BAL) und ggfs. einer transbronchialen Biopsie (TBB) indiziert. Direkt nach Probenentnahme sollte eine anti nfektive Therapie nach Leitlinie begonnen und die Immunsuppression angepasst werden . Der häufigste virale Erreger nach Lungentransplantation ist der Cytomegalievirus (CMV). Selbst mit einer prophylaktischen antiviralen Therapie kommt es in einem Drittel der Patienten im ersten Jahr entweder zu einer Neuinfektion oder zu einer Reaktivierung . Ein Mismatch (seropositiver Spender mit seronegativem Empfänger) ist dabei ein eindeutiger Risikofaktor für erhöhte Mortalität . Die Infektion kann heutzutage durch Polymerase- Kettenreaktion (PCR) aus dem Blut/Plasma diagnostiziert werden. Die Therapie besteht in der oralen oder i.v.-Gabe von (Val-)Ganciclovir für 2 Wochen unter Monitoring der PCR. Der quantitative Nachweis von CMV aus der BAL ist variabel, kann jedoch gehäuft zu einem Nachweis einer CMV-Antigenämie führen . Indirekt kommt es zu einer erhöhten Rate an akuten Abstoßungen und der Entwicklung des Bronchiolitis-Obliterans-Syndroms . Eine Prophylaxe mit Valganciclovir wird nach Guidelines (für 6 Monate bei seropositivem Spender und seronegativem Empfänger, ansonsten für 3 Monate) empfohlen . Al erdings konnte bereits gezeigt werden, dass es zu einer Reduktion der Inzidenz von CMV-Erkrankungen bei einer Prophylaxe über 12 Monate im Vergleich mit 3 Monaten kommt . Pilzinfektionen durch Aspergil us- und Candida- Spezies stellen ein großes Problem in der Nachsorge des lungentransplantierten Patienten dar. Bei Candida handelt es sich meist um eine Kolonisation, eine invasive Candidainfektion ist extrem selten . Die Therapie erfolgt durch Fluconazol. Al erdings tritt bei Nonalbicans-Spezies eine Fluconazol-Resistenz auf . Hier sollten neuere Azole wie Voriconazol eingesetzt werden. Der Nachweis von Aspergil us spec. kann sowohl durch eine asymptomatische Kolonisation, eine bronchiale Infektion, ein Aspergil om oder eine invasive Aspergil ose bedingt sein. Es kommt jedoch auch zu extrapulmonalem Befall, z.B. Zentralnervensystem . Atemwegsbeteiligungen insbesondere der Anastomosen kommen in 5 % der Fäl e, gehäuft in den ersten 6 Monaten nach Transplantation vor. Serologisch und in der BAL kann der Nachweis von Aspergil usantigen (Galactomannantest) geführt werden . Al erdings ist die Sensitivität niedrig bei hoher Spezifität. Radiologisch können sowohl einzelne als auch mehrere noduläre Verschattungen oder Ringschatten sowie Konsolidierungen auftreten. Nur in der Zusammenschau der Befunde inklusive der Klinik kann die Diagnose einer invasiven Aspergil ose gestellt werden. Die histologische Sicherung sollte erwogen werden, wenn auf anderem Weg die Diagnose nicht gestellt werden kann und eine empirische Therapie mit Risiken verbunden ist. Voriconazol ist die Therapie der Wahl, Echinocandine und liposomales Amphotericin B sind second-line-Medikamente. Spiegelkontrollen werden empfohlen . Trotz der verbesserten antifungalen Therapie ist die invasive Aspergil ose mit einer hohen Mortalität von bis zu 60 % assozi ert. Dies hängt auch mit pulmonalen Blutungen bei Gefäßarrosionen zusammen. Weiterhin wurde über Bronchialstenosen und Bronchomalazie berichtet, wobei unklar ist, ob die Infektion oder die zugrundeliegende ischämische Zone im Bronchus zu der Infektion prädisponiert hat. Die inhalative Pilzprophylaxe mit Amphotericin B wird in den meisten Zentren bis zur Abheilung der Anastomosen durchgeführt. Randomisierte Studien fehlen. Bei etwa 20% der Empfänger kommt es zu Atemwegskomplikationen . Diese sind durch passagere oder persistierende Ischämien im Bereich der Anastomosen bedingt, weil die Bronchialarterien intraoperativ nicht reanastomosiert werden. In der initialen postoperativen Anastomosenstenosen, Dehiszenzen und Bronchomalazien entwickeln können (Abbildung
Abbildung 1: Hochgradige Hauptbronchusstenose, Eröffnung mit dem elektrischen Messer
Eine Therapie mit Proliferationsinhibitoren wie Sirolimus und Everolimus ist wegen bekannter Wundheilungsstörungen in dieser Phase zu vermeiden. Für die Therapie stehen verschiedene interventionelle Techniken zur Verfügung. Bei Stenosen werden die Ballondilatation und das elektrische Messer eingesetzt, Granulationsgewebe kann mit dem Argonplasmerbeamer oder mittels Laser abgetragen werden. Stents werden zur Behandlung von Strikturen und Restenosen, außerdem zur Überbrückung von Dehiszenzen und Bronchomalazien eingesetzt. Wegen vieler Komplikationen unter Metallstents (SEMS-self- expandable metallic stents) werden neben der Anlage von Silikonstents erste Versuche mit biodegradierbaren Stents (BDS) unternommen, die passager zu einer Stabilisierung des Bronchialsystems führen und sich nach einigen Wochen auflösen . Akute Abstoßung
Die akute zelluläre Abstoßung (ACR) tritt unverändert in einem Drittel der Fäl e im ersten Jahr nach Lungentransplantation auf. Ferner spielt aber auch die akute antikörpervermittelte Abstoßung eine wesentliche Rolle in der Organschädigung und der konsekutiven Entwicklung einer chronischen Abstoßungsreaktion. Die zel uläre Abstoßung verläuft als T- lymphozytär vermittelte Reaktion auf HLA-Antigene des Transplantats und ist definiert als das Vorhandensein von perivaskulären oder peribronchiolären lymphozytären Infiltraten ohne Nachweis einer Infektion in der transbronchialen Biopsie. Die Abstoßung ist meist mit unspezifischen Symptomen wie Dyspnoe, Husten, vermehrtem Sputum, Fieber oder einem unklaren FEV1-Abfall im Spirometer verbunden. Die Patienten sind angehalten, bei geringsten Symptomen oder einem FEV1-Abfall von > 10 % in der Spirometrie das Transplantationszentrum zu kontaktieren. Die bildgebende Diagnostik mit Röntgenthorax und Computertomografie ist weder spezifisch noch sensitiv. Der Goldstandard der Diagnostik der ACR ist weiterhin die transbronchiale Biopsie. Zirka 80 % der Lungentransplantationszentren führen geplante Surveil ancebronchoskopien durch, um auch asymptomatische Abstoßungen zu entdecken . Die akute Abstoßung wird histopathologisch nach der Klassifikation der Lung Rejection Study Group (LRSG) der International Society of Heart and Lung Transplantation (ISHLT) eingeteilt (Tabelle 2).
Tabelle 2: Klassifikation der akuten und chronischen Abstoßung (modifiziert nach ISHLT
)
Die Therapie der akuten Abstoßung ist ab Grad A2 allgemein akzeptiert. Eine Untersuchung
unter 41 Transplantationspneumologen verschiedener Zentren zeigte, dass 80 % eine symptomatische Abstoßung A1, aber nur 35 % einer asymptomatischen A1 therapieren würden . Die Therapie einer akuten ACR erfolgt mittels Kortikosteroidstoßtherapie (500 mg/Tag für 3 Tage), gefolgt von einer absteigenden Dosierung bis zur Erhaltungsdosis. Persistierende oder wiederholte Abstoßungen erfordern 1. eine Wiederholung der Kortikosteroidstoßtherapie, 2. einen Wechsel der Immunsuppression (z.B. CNI-Wechsel), 3. den Einsatz von ATG, IL2-Rezeptorantagonisten, OKT3, Alemtuzumab. Die humorale Abstoßung, AMR
Die antikörpervermittelte Abstoßungsreaktion (Antibody-Mediated Rejection=AMR), auch humorale Abstoßung genannt, wird durch 4 Kriterien bestimmt : 1. donorspezifische anti-HLA-Antikörper (DSA) - Screening auf DSA durch Flowzytometrie mit Nachweis von PRA= percent reactive
- Spezifizierung durch Luminex single antigen bead (SAB) assay
- MFI= mittlere Fluoreszenzintensität
- C1q- Assay = C1q-positive anti-HLA bei Nieren- und Herztransplantation
2. Nachweis von Komplementablagerung in der Biopsie (C4d) 3. histologische kapil äre Inflammation und Gewebezerstörung (Kapil aritis) 4. klinische Hinweise auf Al ograftdysfunktion. Schwangerschaft, Transfusionen, vorausgegangene Transplantationen und Infektionen können zu einer Sensibilisierung führen. Bei einem Organangebot muss bei einem sensibilisierten Empfänger ein „virtuel es crossmatch" durchgeführt werden. Bei Patienten mit einer großen Anzahl von HLA-Antikörpern (‚highly sensitized patients‘) müssen desensibilisierende Maßnahmen präoperativ diskutiert werden, um den Donorpool zu erhöhen. Nach der Transplantation können neue Antikörper auftreten. Dabei unterscheidet man DSA und non-DSA-anti-HLA-Antikörper. DSA treten in 12-56 % der Organempfänger bei Lungentransplantation auf . Diese sind mit einer erhöhten Inzidenz an ACR (A- und B-Rejection), erhöhter BOS-Rate und schlechterer Überlebensrate vergesel schaftet . Weiterhin wurden Non-HLA-Antikörper identifiziert, die mit einem schlechten funktionellen Ergebnis der Patienten vergesel schaftet waren. Die Therapie der humoralen Abstoßungsreaktion begründet sich auf Erfahrungen in der Nierentransplantation und auf Einzelfallberichte aus der Lungentransplantation . Randomisierte, kontrollierte Studien fehlen. Die Therapie der AMR umfasst (allein oder in Plasmapherese – Absorption der zirkulierenden Antikörper intravenöse Immunglobuline – reduziert B-Zel en, blockiert DSA Rituximab – Anti-CD20 Antikörper, B-Zel depletion Die Therapie der DSA führt in 60 % zur Beseitigung der Anti-HLA-Antikörper, die Non-HLA- Antikörper werden nur in 30% entfernt. Bei Beseitigung fanden sich weniger häufig ein BOS und eine geringere Mortalität . Der Proteasominhibitor Bortezomib und der monoklonale Antikörper Eculizumab wurden in der Nierentransplantation erfolgreich zur Beseitigung der DSA eingesetzt . Chronisches Transplantatversagen (CLAD)
Nach den neuesten Statistiken hat sich im Vergleich zu früheren Langzeitverläufen die 5- Jahresüberlebensraten nach Lungentransplantation zwar auf 53 % gebessert, trotzdem sind die Ergebnisse nicht zufriedenstellend . Haupttodesursachen sind Infektionen und die Entwicklung eines chronischen Transplantatversagens (CLAD = chronic lung allograft dysfunction). Unter CLAD werden verschiedene Phänotypen der chronischen Abstoßung zusammengefasst. Die Einteilung des chronischen Transplantatversagens in Neutrophile reversible Allograftdysfunktion (NRAD), Bronchiolitis obliterans (BOS) und Restriktives Therapiemöglichkeiten. Neutrophile reversible Allograftdysfunktion (NRAD)
Die Neutrophilie in der bronchoalveolären Lavage (BAL) wurde schon sehr frühzeitig als prognostischer Marker für die Entwicklung einer BOS registriert. Das Vorhandensein von Neutrophilen in der BAL 3 und 12 Monate nach Lungentransplantation ist für die Entwicklung eines BOS von Bedeutung. Bei einem Teil der Patienten mit BOS und initial ausgeprägter Neutrophilie in der BAL fand sich nach Gabe von Azithromycin in niedriger Dosis (3 x 250 mg/Woche) im Verlauf von 3 Monaten eine Verbesserung des FEV1. NRAD ist ein prognostischer Marker für das Langzeitüberleben nach LuTX . Nach einer Studie von VOS und Kollegen erscheint es sinnvoll, bei der Krankenhausentlassung nach LuTX Azithromycin auch mit dem Ziel der Verhinderung der Entwicklung einer CLAD einzusetzen . Dabei müssen aber die zahlreichen Kontraindikationen (siehe Beitrag Möhlenkamp in diesem Heft) beachtet werden. Bronchiolitis - Obliterans – Syndrom
In den letzten Jahren erfolgte die Einteilung eher klinisch anhand des Bronchiolitis- Obliterans- Syndroms (BOS), welches – nach Ausschluss anderer Ursachen (Infektion, Atemwegsstenose, akute Abstoßung, etc.) - den Abfall des forcierten exspiratorischen Volumens in einer Sekunde (FEV1) im Vergleich zum postoperativen Baselinewert repräsentierte. Risikofaktoren sind in Tabelle 3 zusammengefasst.
Tabelle 3: Risikofaktoren für die Entstehung von BOS
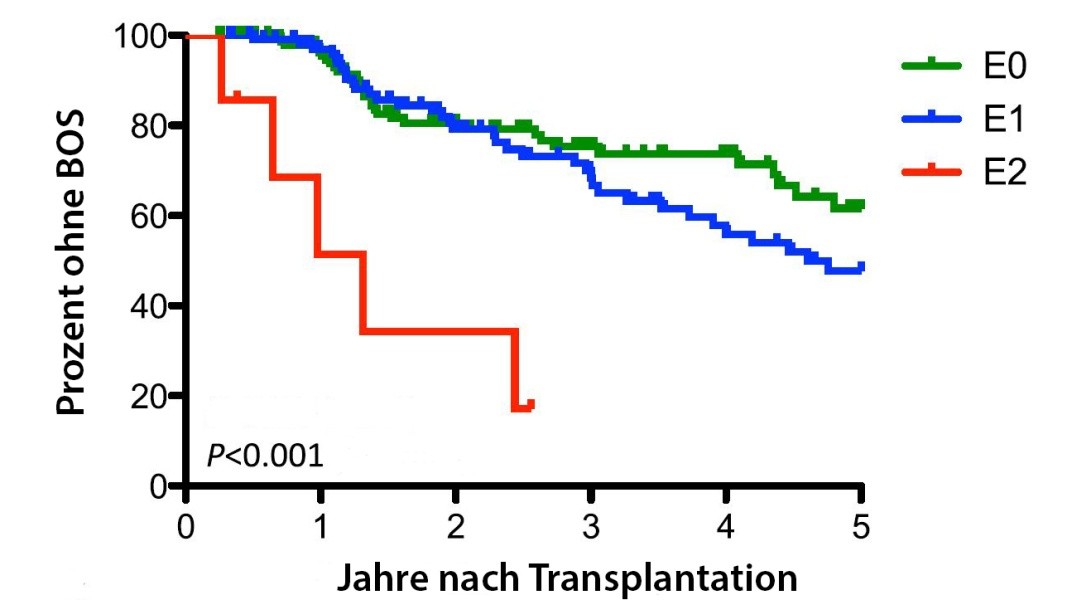
Der BOS-Grad wird als relativer Abfall vom postoperativen Baselinewert angegeben. Histologisch findet sich eine obliterative Bronchiolitis (OB). Dabei handelt es sich um einen inflammatorisch- fibrosierenden Prozess der kleinen Atemwege mit subepithelialer Fibrose und abschnittsweiser Einengung oder Okklusion des Lumens. Die Bronchoskopie ist häufig nicht diagnostisch. Eine lymphozytäre Infiltration der großen Atemwege innerhalb der ersten 90 Tage nach Lungentransplantation ist offensichtlich jedoch mit einem erhöhten Risiko für das spätere Auftreten eines BOS assozi ert (Abbildung 2) [34]. Der Verlauf kann sowohl
chronisch progredient über Jahre als auch abrupt innerhalb von Wochen sein. Insbesondere bei einem früh auftretenden, sehr schnell verlaufendem BOS ist die Überlebensrate schlecht Die Therapiemöglichkeiten für BOS sind relativ eingeschränkt. Ziel ist die Stabilisierung des FEV1-Abfalls. Der Wechsel der Immunsuppressiva von Azathioprin auf Mycophenolat mofetil sowie von Cyclosporin auf Tacrolimus wird häufig durchgeführt. Es liegen aber keine kontrollierten Studien zur Sinnhaftigkeit und Effizienz dieser Maßnahme vor. Im Rahmen der cytolytischen Therapie werden Präparate mit T-Zel depletion und späterer T- Zel funktionseinschränkung (z.B. ATG= Antithymozytenglobulin) eingesetzt. Im Rahmen von Salvagetherapien konnte eine Verlangsamung des FEV1-Abfalls beobachtet werden. Azithromycin ist insbesondere bei Patienten mit vorbestehender Neutrophilie wirksam (siehe NRAD) (s.o.). Doch sollte bei jedem Patient mit BOS ein Therapieversuch mit Azithromycin gemacht werden . Die extrakorporale Photopherese (ECP) beinhaltet die Entnahme einer Blutfraktion des Patienten und Isolation der Leukozyten, die dann ultraviolettem Licht in Anwesenheit von 8-Methoxypsoralen ausgesetzt werden. Die ECP wird an zwei aufeinanderfolgenden Tagen in regelmäßigen Intervallen für 3-12 Monate durchgeführt . Jaksch et al. beschrieben eine Stabilisierung bei 61 % über 6 Monate. Responder hatten ein signifikant höheres Überleben und benötigten seltener eine Retransplantation als Non- Responder. In einer deutschen Studie wurden zwischen 2007 und 2011 insgesamt 65 mit ECP behandelte Patienten eingeschlossen. Bei 54 % kam es entweder zu einem Anstieg des FEV1 (n=8) um 10 % oder zu einer Stabilisierung(n=27) . Die ECP wird gut vertragen, ist jedoch kostenintensiv. Restriktives Allograft Syndrom
Darüber hinaus gibt es eine Patientengruppe, die ebenfalls durch einen frühzeitigen FEV1- Abfall um 20% gekennzeichnet ist, weiterhin jedoch ein restriktives Lungenfunktionsmuster mit einem Abfall der Totalen Lungenkapazität (TLC) um mindestens 10% aufweist . RAS tritt in 25 -35 % aller Patienten mit CLAD auf. In der Computertomografie findet sich deutlich mehr Milchglastrübung, Fibrose in den Oberlappen und Honigwabenbildung. Derzeit gibt es keine standardisierte Therapie. Der Stellenwert von Pirfenidon, das neuerdings für die Behandlung der idiopathischen Lungenfibrose zugelassen ist, wird derzeit untersucht. Leider ist die Retransplantation die einzige gesicherte Therapieoption, obwohl kleine Nebenwirkungsprofil beachtet werden sollte . Tabelle 4: Charakteristika der CLAD-Entitäten NRAD, BOS und RAS (adaptiert nach
Viele Patienten verlieren in der Phase vor der Lungentransplantation erheblich an Muskelmasse und müssen ihre Leistungsfähigkeit nach der Transplantation wieder mühsam aufbauen. Einem strukturierten Trainingsprogramm kommt dabei entscheidende Bedeutung zu. Langer und Kollegen untersuchten den Effekt eines überwachten Trainingsprogramms im Verlauf des ersten Jahres nach Lungentransplantation hinsichtlich der Verbesserung der Leistungsfähigkeit und der kardiovaskulären Morbidität (Abbildung 3) . In dieser Studie
erhielten 21 Patienten das Trainingsprogramm und 19 Patienten wurden als Kontrollgruppe ohne dieses Programm behandelt. Nach einem Jahr zeigte sich in der Trainingsgruppe gegenüber den Kontrollen eine signifikante Zunahme der Quadrizepskraft, der 6 Minuten Gehstrecke und der Zeit, die die Patienten herumlaufend verbringen. Diese Daten unterstreichen die Bedeutung eines anhaltenden Trainings für eine Maximierung des funktionellen Erfolges und der Lebensqualität nach Lungentransplantation. Fazit für die Praxis:
Die Lungentransplantation ist eine etablierte Therapieoption für Patienten mit einer terminalen Lungenerkrankung. Nach Ausschöpfung aller alternativen Therapieoptionen und nach ausführlicher Kandidatenselektion kann die Lungentransplantation für ausgewählte Patienten eine Therapiemöglichkeit sein. Nach der Transplantation muss sich das Transplantationsteam komplexen Herausforderungen stellen. Darunter fallen das primäre Organversagen, Abstoßungsreaktionen, Infektionen und chirurgische Komplikationen. Das Langzeitüberleben wird durch CLAD bestimmt. Durch ein besseres Verständnis der Phänotypen von CLAD erhofft man sich eine spezifischere Therapie und verlängerte Überlebensraten.
Abbildungen und Tabellen
Abbildung 1: Hochgradige Hauptbronchusstenose, Eröffnung mit dem elektrischen Messer
(mit Genehmigung von L.Freitag, Abteilung Interventionelle Pneumologie, Ruhrlandklinik, Westdeutsches
Lungenzentrum am Universitätsklinikum Essen, Universität Duisburg-Essen)
Abbildung 2: Einfluss der Ausprägung einer lymphozytären Bronchitis (E0, E1, E2) der
großen Atemwege auf das BOS-freie Überleben (modifiziert nach )
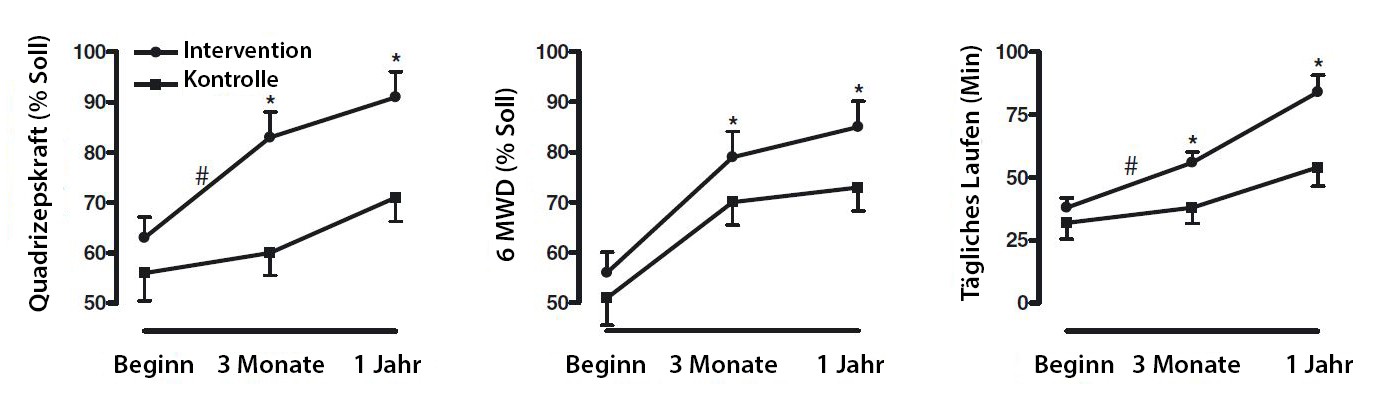
Abbildung 3: Effekt eines dreimonatigen Trainingsprogramms im ersten Jahr nach
Lungentransplantation auf Parameter der körperlichen Leistungsfähigkeit (modifiziert nach
Langer D et al.
Tabelle 1: Der Lung Al ocation Score (LAS)
- Einführung 2005 in den USA/ Adaptation Eurotransplant 2011
- Für Patienten > 12 Jahre
- Organvergabe nach Dringlichkeit und Erfolgsaussicht unter Vernachlässigung der
- Score von 0-100
1. Senkung der Wartelistensterblichkeit
2. Verbesserung des Transplantationserfolgs
3. Erhöhung der aktiven Listenpatienten
- z.B. durchschnittlicher LAS bei verschiedenen Diagnosegruppen:
COPD 32,6, IPF 40,9, CF 36,2
- Low LAS < 50 Listungspatienten mit nur leicht bis mäßig erhöhter Mortalität,
teilweise Überlebensvorteil
- High LAS 50-75 aufgrund der Krankheitsschwere hospitalisierte Patienten
kritisch kranke, beatmete Patienten/ECMO, deutlich
niedrigere Überlebensraten und höhere
Ressourcenbindung
Tabelle 2: Klassifikation der akuten und chronischen Abstoßung (modifiziert nach ISHLT
)
A
Akute zelluläre
Akute zelluläre
vaskuläre
Abstoßung
der kleinen
Atemwege
Nicht klassifizierbar
Chronische
Chronische
vaskuläre
Abstoßung
Abstoßung der
großen Atemwege
keine chronische
minimal bis milde
moderate bis schwere
Tabelle 3: Risikofaktoren für die Entstehung von BOS
- Akute zelluläre Abstoßung (ACR)
einzelne A-grade- ACR multiple Episoden high-grade ACR late-onset-A-grade-ACR
- B - grade ACR (lymphocytic bronchiolitis - LB)
Schwere der Abstoßung
- antikörpervermittelte Abstoßung (AMR) - Bedeutung unklar, eher in
Verbindung hyperakute Abstoßung
HLA-Antikörper Nachweis von C4d ist nicht spezifisch für AMR
- Antikörper gegen die epithelialen Selbst-Antigene colV und Kα1T
(Autoimmunität)
- Innate Immunity
Polymorphismen
Toll-like-Rezeptoren
- Gastroösophageale Refluxkrankheit (GERD)
- Infektion
Cytomegalievirus CMV CARV HHV-6 Chlamydia pneumonia Kolonisation mit Pseudomonas aeruginosa/Asperg.
Tabelle 4: Charakteristika der CLAD-Entitäten NRAD, BOS und RAS (adaptiert nach
Atemwegsentzündung?
Atemwegsentzündung
Atemwegsentzündung
BAL: Neutrophile>15%
keine grobblasigen RGs
minimale grobblasige RGs
Rasselgeräusche(RGs)
minimales Sputum
vermehrte Sputumproduktion
meist früh nach Tx
anfangs entzündlich,
Bronchiolitis obliterans,
Fibrose, verdickte
möglicher Übergang in Fibrose
normales Parenchym
Interlobärsepten und Pleura
Konsolidierungen,
Atemwegsverdickungen,
retikuläre Zeichnung
Schleimpfröpfe,
persistierende Infiltrate
zentrilobuläre Knötchen
restriktiv (TLC-Abfal >10%)
Abkürzungen: BAL, bronchoalveoläre Lavage; BOS, Bronchiolitis obliterans; NRAD, neutrophile reversible Allograftdysfunktion;
OB, obliterative Bronchiolitis; RAS, restriktives Allograft Syndrom; TLC, totale Lungenkapazität
Literatur
Benden C, Edwards LB, Kucheryavaya AY et al. The registry of the international
society for heart and lung transplantation: sixteenth official pediatric lung and heart-
lung transplantation report-2013; focus theme: age. J Heart Lung Transplant 2013;
32: 989-97.
Lease ED, Zaas DW. Update on infectious complications following lung
transplantation. Curr Opin Pulm Med 2011; 17: 206-9.
Kamler M, Pizanis N. Aktuel er Stand der Lungentransplantation. Zeitschrift für Herz-
,Thorax- und Gefäßchirurgie 2012; 27: 235-42.
Bundesärztekammer. Richtlinien zur Organtransplantation gem. § 16 Abs. 1 S. 1 Nrn.
2 u. 5 TPG. Deutsches Ärzteblatt 2011; 12.
Pilarczyk K, Osswald BR, Pizanis N et al. Use of donors who have suffered
cardiopulmonary arrest and resuscitation in lung transplantation. Eur J Cardiothorac
Surg 2011; 39: 342-7.
Pizanis N, Gillner S, Kamler M et al. Cold-induced injury to lung epithelial cells can be
inhibited by iron chelators - implications for lung preservation. Eur J Cardiothorac
Surg 2011; 40: 948-55.
Warnecke G, Moradiellos J, Tudorache I et al. Normothermic perfusion of donor lungs
for preservation and assessment with the Organ Care System Lung before bilateral
transplantation: a pilot study of 12 patients. Lancet 2012; 380: 1851-8.
Cypel M, Yeung JC, Liu M et al. Normothermic ex vivo lung perfusion in clinical lung
transplantation. N Engl J Med 2011; 364: 1431-40.
Aigner C, Slama A, Hotzenecker K et al. Clinical ex vivo lung perfusion--pushing the
limits. Am J Transplant 2012; 12: 1839-47.
Egan TM, Murray S, Bustami RT et al. Development of the new lung allocation
system in the United States. Am J Transplant 2006; 6: 1212-27.
Christie JD, Edwards LB, Kucheryavaya AY et al. The Registry of the International
Society for Heart and Lung Transplantation: twenty-seventh official adult lung and
heart-lung transplant report--2010. J Heart Lung Transplant 2010; 29: 1104-18.
Cypel M, Yeung JC, Hirayama S et al. Technique for prolonged normothermic ex vivo
lung perfusion. J Heart Lung Transplant 2008; 27: 1319-25.
Warnecke G. Operative Technik der Lungentransplantation. Zeitschrift für Herz-
,Thorax- und Gefäßchirurgie 2013; 27: 26-30.
Hoopes CW, Kukreja J, Golden J et al. Extracorporeal membrane oxygenation as a
bridge to pulmonary transplantation. J Thorac Cardiovasc Surg 2013; 145: 862-7;
discussion 7-8.
Christie JD, Edwards LB, Kucheryavaya AY et al. The Registry of the International
Society for Heart and Lung Transplantation: 29th adult lung and heart-lung transplant
report-2012. J Heart Lung Transplant 2012; 31: 1073-86.
Treede H, Glanvil e AR, Klepetko W et al. Tacrolimus and cyclosporine have
differential effects on the risk of development of bronchiolitis obliterans syndrome:
results of a prospective, randomized international trial in lung transplantation. J Heart
Lung Transplant 2012; 31: 797-804.
Gullestad L, Mortensen SA, Eiskjaer H et al. Two-year outcomes in thoracic
transplant recipients after conversion to everolimus with reduced calcineurin inhibitor
within a multicenter, open-label, randomized trial. Transplantation 2010; 90: 1581-9.
Bhorade S, Ahya VN, Baz MA et al. Comparison of sirolimus with azathioprine in a
tacrolimus-based immunosuppressive regimen in lung transplantation. Am J Respir
Crit Care Med 2011; 183: 379-87.
Euvrard S, Morelon E, Rostaing L et al. Sirolimus and secondary skin-cancer
prevention in kidney transplantation. N Engl J Med 2012; 367: 329-39.
Hil en U, Griewank K, Sommerwerck U et al. Tumor regression and sirolimus-based
therapy in lung transplantation. J Heart Lung Transplant 2013; 32: 938-9.
Christie JD, Edwards LB, Kucheryavaya AY et al. The Registry of the International
Society for Heart and Lung Transplantation: Twenty-eighth Adult Lung and Heart-
Lung Transplant Report--2011. J Heart Lung Transplant 2011; 30: 1104-22.
Jaksch P, Wiedemann D, Augustin V et al. Antithymocyte globulin induction therapy
improves survival in lung transplantation for cystic fibrosis. Transpl Int 2013; 26: 34-
41.
Gupta D, Agarwal R, Aggarwal AN et al. Guidelines for diagnosis and management of
community- and hospital-acquired pneumonia in adults: Joint ICS/NCCP(I)
recommendations. Lung India 2012; 29: S27-62.
Palmer SM, Limaye AP, Banks M et al. Extended valganciclovir prophylaxis to
prevent cytomegalovirus after lung transplantation: a randomized, controlled trial. Ann
Intern Med 2010; 152: 761-9.
Schlischewsky E, Fuehner T, Warnecke G et al. Clinical significance of quantitative
cytomegalovirus detection in bronchoalveolar lavage fluid in lung transplant
recipients. Transpl Infect Dis 2013; 15: 60-9.
Snydman DR, Limaye AP, Potena L, Zamora MR. Update and review: state-of-the-art
management of cytomegalovirus infection and disease following thoracic organ
transplantation. Transplant Proc 2011; 43: S1-S17.
Kotton CN, Kumar D, Caliendo AM et al. International consensus guidelines on the
management of cytomegalovirus in solid organ transplantation. Transplantation 2010;
89: 779-95.
Ruhnke M, Rickerts V, Cornely OA et al. Diagnosis and therapy of Candida infections:
joint recommendations of the German Speaking Mycological Society and the Paul-
Ehrlich-Society for Chemotherapy. Mycoses 2011; 54: 279-310.
Lewis RE, Viale P, Kontoyiannis DP. The potential impact of antifungal drug
resistance mechanisms on the host immune response to Candida. Virulence 2012; 3:
368-76.
Kourkoumpetis TK, Desalermos A, Muhammed M, Mylonakis E. Central nervous
system aspergil osis: a series of 14 cases from a general hospital and review of 123
cases from the literature. Medicine (Baltimore) 2012; 91: 328-36.
Beirao F, Araujo R. State of the art diagnostic of mold diseases: a practical guide for
clinicians. Eur J Clin Microbiol Infect Dis 2013; 32: 3-9.
Porhownik NR. Airway complications post lung transplantation. Curr Opin Pulm Med
2013; 19: 174-80.
Lischke R, Pozniak J, Vondrys D, El iott MJ. Novel biodegradable stents in the
treatment of bronchial stenosis after lung transplantation. Eur J Cardiothorac Surg
2011; 40: 619-24.
Gottlieb J, Fuehner T, Dierich M et al. Are metallic stents real y safe? A long-term
analysis in lung transplant recipients. Eur Respir J 2009; 34: 1417-22.
Sundset A, Lund MB, Hansen G et al. Airway complications after lung transplantation:
long-term outcome of silicone stenting. Respiration 2012; 83: 245-52.
Gordon IO, Bhorade S, Vigneswaran WT et al. SaLUTaRy: survey of lung transplant
rejection. J Heart Lung Transplant 2012; 31: 972-9.
Greenland JR, Jones KD, Hays SR et al. Association of large-airway lymphocytic
bronchitis with bronchiolitis obliterans syndrome. Am J Respir Crit Care Med 2013;
187: 417-23.
Tait BD, Susal C, Gebel HM et al. Consensus guidelines on the testing and clinical
management issues associated with HLA and non-HLA antibodies in transplantation.
Transplantation 2013; 95: 19-47.
Yabu JM, Higgins JP, Chen G et al. C1q-fixing human leukocyte antigen antibodies
are specific for predicting transplant glomerulopathy and late graft failure after kidney
transplantation. Transplantation 2011; 91: 342-7.
Chin C, Chen G, Sequeria F et al. Clinical usefulness of a novel C1q assay to detect
immunoglobulin G antibodies capable of fixing complement in sensitized pediatric
heart transplant patients. J Heart Lung Transplant 2011; 30: 158-63.
Berry G, Burke M, Andersen C et al. Pathology of pulmonary antibody-mediated
rejection: 2012 update from the Pathology Council of the ISHLT. J Heart Lung
Transplant 2013; 32: 14-21.
Yousem SA, Zeevi A. The histopathology of lung allograft dysfunction associated with
the development of donor-specific HLA alloantibodies. Am J Surg Pathol 2012; 36:
987-92.
Hachem RR, Yusen RD, Meyers BF et al. Anti-human leukocyte antigen antibodies
and preemptive antibody-directed therapy after lung transplantation. J Heart Lung
Transplant 2010; 29: 973-80.
Lobo LJ, Aris RM, Schmitz J, Neuringer IP. Donor-specific antibodies are associated
with antibody-mediated rejection, acute cellular rejection, bronchiolitis obliterans
syndrome, and cystic fibrosis after lung transplantation. J Heart Lung Transplant
2013; 32: 70-7.
Snyder LD, Wang Z, Chen DF et al. Implications for human leukocyte antigen
antibodies after lung transplantation: a 10-year experience in 441 patients. Chest
2013; 144: 226-33.
Roberts DM, Jiang SH, Chadban SJ. The treatment of acute antibody-mediated
rejection in kidney transplant recipients-a systematic review. Transplantation 2012;
94: 775-83.
Lemy A, Toungouz M, Abramowicz D. Bortezomib: a new player in pre- and post-
transplant desensitization? Nephrol Dial Transplant 2010; 25: 3480-9.
Woodle ES, Al oway RR, Girnita A. Proteasome inhibitor treatment of antibody-
mediated allograft rejection. Curr Opin Organ Transplant 2011; 16: 434-8.
Verleden GM, Vos R, Verleden SE et al. Survival determinants in lung transplant
patients with chronic allograft dysfunction. Transplantation 2011; 92: 703-8.
Vos R, Vanaudenaerde BM, Verleden SE et al. A randomised controlled trial of
azithromycin to prevent chronic rejection after lung transplantation. Eur Respir J
2011; 37: 164-72.
Finlen Copeland CA, Snyder LD, Zaas DW et al. Survival after bronchiolitis obliterans
syndrome among bilateral lung transplant recipients. Am J Respir Crit Care Med
2010; 182: 784-9.
Weigt SS, DerHovanessian A, Wallace WD et al. Bronchiolitis obliterans syndrome:
the Achil es' heel of lung transplantation. Semin Respir Crit Care Med 2013; 34: 336-
51.
Jaksch P, Scheed A, Keplinger M et al. A prospective interventional study on the use
of extracorporeal photopheresis in patients with bronchiolitis obliterans syndrome
after lung transplantation. J Heart Lung Transplant 2012; 31: 950-7.
Greer M, Dierich M, De Wal C et al. Phenotyping established chronic lung allograft
dysfunction predicts extracorporeal photopheresis response in lung transplant
patients. Am J Transplant 2013; 13: 911-8.
Sato M, Waddell TK, Wagnetz U et al. Restrictive allograft syndrome (RAS): a novel
form of chronic lung allograft dysfunction. J Heart Lung Transplant 2011; 30: 735-42.
Kohno M, Perch M, Andersen E et al. Treatment of intractable interstitial lung injury
with alemtuzumab after lung transplantation. Transplant Proc 2011; 43: 1868-70.
Vanaudenaerde BM, Meyts I, Vos R et al. A dichotomy in bronchiolitis obliterans
syndrome after lung transplantation revealed by azithromycin therapy. Eur Respir J
2008; 32: 832-43.
Verleden SE, Vandermeulen E, Ruttens D et al. Neutrophilic reversible allograft
dysfunction (NRAD) and restrictive allograft syndrome (RAS). Semin Respir Crit Care
Med 2013; 34: 352-60.
Langer D, Burtin C, Schepers L et al. Exercise training after lung transplantation
improves participation in daily activity: a randomized controlled trial. Am J Transplant
2012; 12: 1584-92.
Smits JM, Nossent GD, de Vries E et al. Evaluation of the lung allocation score in
highly urgent and urgent lung transplant candidates in Eurotransplant. J Heart Lung
Transplant 2011; 30: 22-8.
Chen H, Shiboski SC, Golden JA et al. Impact of the lung allocation score on lung
transplantation for pulmonary arterial hypertension. Am J Respir Crit Care Med 2009;
180: 468-74.
Merlo CA, Weiss ES, Orens JB et al. Impact of U.S. Lung Al ocation Score on survival
after lung transplantation. J Heart Lung Transplant 2009; 28: 769-75.
Russo MJ, Iribarne A, Hong KN et al. High lung allocation score is associated with
increased morbidity and mortality following transplantation. Chest 2010; 137: 651-7.
DeNicola MM, Weigt SS, Belperio JA et al. Pathologic findings in lung allografts with
anti-HLA antibodies. J Heart Lung Transplant 2013; 32: 326-32.
Saini D, Weber J, Ramachandran S et al. Al oimmunity-induced autoimmunity as a
potential mechanism in the pathogenesis of chronic rejection of human lung
allografts. J Heart Lung Transplant 2011; 30: 624-31.
Tiriveedhi V, Angaswamy N, Brand D et al. A shift in the collagen V antigenic epitope
leads to T helper phenotype switch and immune response to self-antigen leading to
chronic lung allograft rejection. Clin Exp Immunol 2012; 167: 158-68.
Kastelijn EA, van Moorsel CH, Rijkers GT et al. Polymorphisms in innate immunity
genes associated with development of bronchiolitis obliterans after lung
transplantation. J Heart Lung Transplant 2010; 29: 665-71.
Mertens V, Blondeau K, Van Oudenhove L et al. Bile acids aspiration reduces
survival in lung transplant recipients with BOS despite azithromycin. American journal
of transplantation : official journal of the American Society of Transplantation and the
American Society of Transplant Surgeons 2011; 11: 329-35.
Paraskeva M, Bailey M, Levvey BJ et al. Cytomegalovirus replication within the lung
allograft is associated with bronchiolitis obliterans syndrome. American journal of
transplantation : official journal of the American Society of Transplantation and the
American Society of Transplant Surgeons 2011; 11: 2190-6.
Kumar D, Husain S, Chen MH et al. A prospective molecular surveil ance study
evaluating the clinical impact of community-acquired respiratory viruses in lung
transplant recipients. Transplantation 2010; 89: 1028-33.
Gottlieb J, Schulz TF, Welte T et al. Community-acquired respiratory viral infections in
lung transplant recipients: a single season cohort study. Transplantation 2009; 87:
1530-7.
Gottlieb J, Mattner F, Weissbrodt H et al. Impact of graft colonization with gram-
negative bacteria after lung transplantation on the development of bronchiolitis
obliterans syndrome in recipients with cystic fibrosis. Respir Med 2009; 103: 743-9.
Weigt SS, Elashoff RM, Huang C et al. Aspergil us colonization of the lung allograft is
a risk factor for bronchiolitis obliterans syndrome. Am J Transplant 2009; 9: 1903-11.
Source: http://www.lutx.de/wp-content/uploads/2014/03/Lungentransplantation-Herz140107-end-mit-Tabellen-und-Abbildungen.pdf
268_273_pscherer
268_273_pscherer 7.8.15 8:56 Stránka 268 268/ ACTA CHIR. ORTHOP. TRAUM. ČECH., 82, 2015, Delayed Fracture Healing in Diabetics with Distal Radius Fractures Opožděné hojení zlomenin u diabetiků se zlomeninou distálního radia S. PSCHERER1, G. H. SANDMANN2, S. EHNERT3, A. K. NUSSLER3, U. STÖCKLE3, T. FREUDE3
mnassa.org.za
The Celestial by Magda Streicher It is only appropriate to conclude the Image source: Starry Night Pro IYA2009 by considering one of the most vital parts of the telescope – the reticle – immortalised by the constel- lation Reticulum. Reticulum is Latin for ‘net'. One can imagine astronomers fishing out the discoveries from among rhomboidal crosshairs which he used to